Paration
 | |
| Substància | compost químic, combustible líquid de classe IIIB i insecticida |
|---|---|
| Massa molecular | 291,033 uma |
| Estructura química | |
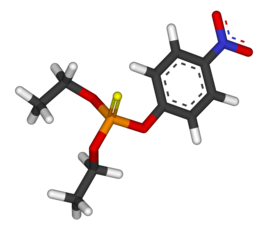
| Fórmula química | C₁₀H₁₄NO₅PS |
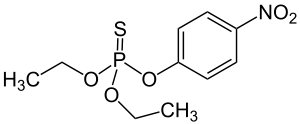 | |
SMILES canònic | Model 2D CCOP(=S)(OCC)OC1=CC=C(C=C1)[N+](=O)[O-] |
| InChI | Model 3D |
| Propietats | |
| Densitat | 1,27 g/cm³ (a 20 °C) |
| Solubilitat | 0,001 g/100 g dissolvent (aigua, 68 °F) |
| Punt de fusió | 6 °C |
| Punt d'ebullició | 375 °C (a 760 Torr) |
| Pressió de vapor | 4,0E-5 mm Hg (a 68 °F) |
| Perills | |
| Límit d'exposició promig ponderat en el temps | 0,05 mg/m³ (10 h, sense valor) 0,1 mg/m³ (8 h, Estats Units d'Amèrica) |
| Punt d'inflamabilitat | 200 °C |
| IDLH | 10 mg/m³ |
Paration, Paratió, Parathion, o etil paration o dietil paration, és un compost químic organofosforat. És un potent insecticida i acaricida. Originàriament el va desenvolupar l’empresa IG Farben a la dècada de 1940. És molt tòxic per als organismes que no són el seu objectiu incloent els humans. El seu ús o està prohibit o bé molt restringit en molts països, i hi ha propostes de prohibir-lo per qualsevol ús. El metil paration n’està estretament relacionat.
Contingut
1 Metil paration
2 Història
3 Propietats
4 Síntesi
5 Aplicacions
6 Activitat com insecticida
7 Degradació
8 Seguretat
9 Referències
10 Enllaços externs
Metil paration
El metil paration, "Parathion-methyl" (CAS#298-00-0), també conegut com a "methyl parathion" o "dimethyl parathion", també es va desenvolupar i comercialitzar per a usos similars als del paration. És menys tòxic que aquest. Alguns noms comercials del metil paratió inclouen els de Bladan M, Metaphos, ME605, i E601.
Història

Ampolla amb paration de la marca alemanya E605
El paration va ser desenvolupat pel Dr. Gerhard Schrader per al trust alemany IG Farben a la dècada de 1940. Després de la Segona guerra Mundial i el col·lapse de IG Farben degut als judicis per crims de guerra, els aliats occidentals van permetre la patent, i el paration es va comercialitzar a tot el món sota diferents noms comercials.
Propietats
En estat pur el paration és una pols blanca cristal·lina, però normalment es distribueix com un líquid marró que fa pudor d’ous podrits o d’all. L’insecticida és més o menys estable però s’enfosqueig quan s’exposa a la llum solar
Síntesi
El paration se sintetitza a partir de l’àcid dietil ditiofosfòric (C2H5O)2PS2H. Aquest àcid es tracta amb nitrofenolat 4 de sodi[1]
- 2 (C2H5O)2P(S)SH + 3 Cl2 → 2 (C2H5O)2P(S)Cl + S2Cl2 + 2 HCl
- (C2H5O)2P(S)Cl + NaOC6H4NO2 → (C2H5O)2P(S)OC6H4NO2 + NaCl
Aplicacions
Com aplaguicida el paration normalment es fa servir en forma d’esprai. Sovint s’aplica en cotoner, plantes d’arròs i arbres fruiters. La concentració usual de les solucions preparades és de 0,05 ao 0,1%. Aquest producte és prohibit d’usar en molts conreus alimentaris.
Activitat com insecticida
El paration actua sobre l’enzim acetilcolnesterasa, però indirectament. Després de ser ingerit pels insectes o pels humans el paration s’oxida per part de les oxidases i dóna paraoxon, substituint el doble enllaç de sofre per oxigen.[2]
- (C2H5O)2P(S)OC6H4NO2 + 1/2 O2 → (C2H5O)2P(O)OC6H4NO2 + S
L’ester de fosfat és més reactiu en els organismes que elèster de fosforotiolat, ja que els àtoms de fòsfor passen a sser molt més electronegatius.[2]
Degradació
La degradació del paration porta a productes més solubles en aigua. La hidròlisi, que desactiva la molècula, ocorre en l’enllaç èster aril resultant en dietiltiofosfat i 4-nitrofenol.[2]
- (C2H5O)2P(S)OC6H4NO2 + H2O → HOC6H4NO2 + (C2H5O)2P(S)OH
La degradació en condicions anaeròbiques és diferent i el grup nitro del paration es redueix a amina.
- (C2H5O)2P(S)OC6H4NO2 + 6 H → (C2H5O)2P(S)OC6H4NH2 + 2 H2O
Seguretat
El paration és un inhibidor de la colinesterasa. Generalment interromp el sistema nerviós inhibint l’acetilcolinesterasa. S’absorbeix per la pell, les membranes mucoses i oralment. Una vegada transformat en paraoxon produeix mal de cap, convulsions, vòmits, diarrea severa, dolor abdominal i altres símptomes finalment dóna edema pulmonar i parada respiratòria. L’antídot més comú és l’atropina. S’ha usat amb freqüència per a suïcidar-se. També s’ha usat com arma química especialment en la guerra de Rodèsia
.[3]
També és un possible carcinogen.[4] Studies show that parathion is toxic to fetuses, but does not cause birth defects.[5]
Està classificat per la UNEP com Contaminant Orgànic Persistent i la Classe de toxicitat de WHO com "Ia, Extremadament Perillós".
El paration és molt tòxic per les abelles, peixos, ocells, i altres formes de vida silvestree.[5] Es pot substituir el paration per molts altres productes més segurs i menys tòxics com altres organofosfats, carbamats, o piretroides sintètics.
Referències
↑ Fee, D. C.; Gard, D. R.; Yang, C. “Phosphorus Compounds” Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons: New York, 2005. doi:10.1002/0471238961.16081519060505.a01.pub2
↑ 2,02,12,2 Metcalf, R. L. “Insect Control” Ullman’s Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA: New York, 2002. doi: 10.1002/14356007.a14_263
↑ Moorcraft, Paul and McLaughlin, Peter. The Rhodesian War: A Military History. Yorkshire: Pen & Sword, 2008, p. 106
↑ «Parathion». Integrated Risk Information System. U. S. Environmental Protection Agency, 26-01-2007.
↑ 5,05,1 «Pesticide Information Profiles - Parathion». Extension Toxicology Network. Oregon State University, September 1993.
Enllaços externs
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Paration |
ATSDR - Methyl Parathion Expert Panel Report U.S. Department of Health and Human Services (public domain)