Fenol
 | |
| Substància | compost químic, medicament, sòlid inflamable i fenols |
|---|---|
| Massa molecular | 94,042 uma |
| Estructura química | |
| Fórmula química | C₆H₆O |
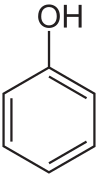 | |
SMILES canònic | Model 2D C1=CC=C(C=C1)O |
| InChI | Model 3D |
| Propietats | |
| Densitat | 1,06 g/cm³ (a 20 °C) |
| Acidesa (pKa) | 9,89 |
| Solubilitat | 9 g/100 g dissolvent (aigua, 77 °F) |
| Punt de fusió | 43 °C |
| Punt d'ebullició | 182 °C (a 760 Torr) |
| Entalpia estàndard de formació | -162,944 kJ/mol |
| Pressió de vapor | 0,4 mm Hg (a 68 °F) |
| Perills | |
| Límit inferior d'explosivitat | 1,8 % |
| Límit superior d'explosivitat | 8,6 % |
| Límit d'exposició promig ponderat en el temps | 19 mg/m³ (8 h, Estats Units d'Amèrica) |
| Límit d'exposició sostre | 60 mg/m³ (sense valor) |
| Punt d'inflamabilitat | 79 °C |
| IDLH | 962,5 mg/m³ |
El fenol és un compost orgànic aromàtic amb la molècula formada per un anell de benzè en què un hidroxil ocupa el lloc d'un hidrogen. S'utilitza per desinfectar, com a reactiu en anàlisis químiques i per obtenir resines artificials.
Propietats
El fenol té una solubilitat limitada en l'aigua (8.3 g per 100 ml). És lleugerament àcid, ja que el fenol té una tendència moderada a perdre l'ió H+ del grup hidroxil, generant l'anió fenòxid C6H5O− altament soluble en aigua: és per aquest motiu que també se l'anomena àcid fènic. Comparat amb els alcohols alifàtics el fenol és molt més àcid, i fins i tot reacciona amb NaOH per a perdre el catió H+, reacció que no es produeix amb els alcohols alifàtics. Aquesta reactivitat és deu a la sobreposició entre els orbitals dels parell d'electrons de l'oxigen i el sistema aromàtic, ajudant a deslocalitzar la càrrega negativa de l'ió per l'anell i estabilitzant l'anió. Aquest efecte però es veu atenuat per la relativament alta electronegativitat de l'oxigen.[1]
Història
El fenol va ser descobert el 1834 per Runge, que el va extreure (amb impureses) del quitrà d'hulla. Set anys més tard, el químic francès Auguste Laurent el va obtenir de forma pura.
Durant la Segona Guerra Mundial fou utilitzat pels nazis alemanys als camps de concentració com a medi d'extermini en forma d'injecció intracardíaca.[2]
Referències
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Fenol |
↑ «The Acidity of Phenol». ChemGuide. Jim Clark. [Consulta: 28 octubre 2006].
↑ Czech, Danuta; Iwaszko, Tadeusz; et al.; Selvage, Douglas (trd.). Piper, Franciszek (ed.); Swiebocka, Teresa (ed.). Auschwitz - Nazi Death Camp. 5a ed.. Oświęcim - Polònia: The Auschwitz-Birkenau State Museum in Oświęcim, 2011. ISBN 978-83-60210-37-6 [Consulta: 12 setembre 2012]. (anglès)