Amoníac
| L'article o secció necessita millores quant al seu format. |
 | |
| Substància | compost químic |
|---|---|
| Massa molecular | 17,027 uma |
| Estructura química | |
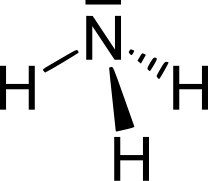
| Fórmula química | NH₃ |
 | |
SMILES canònic | Model 2D N |
| InChI | Model 3D |
| Propietats | |
| Densitat | 0,0007723 kg/m³ (a 0 °C, gas) |
| Velocitat del so | 415 m/s (0 °C, gas) |
| Acidesa (pKa) | 9,21 |
| Solubilitat | 34 g/100 g dissolvent (aigua, 68 °F) |
| Punt de fusió | −78 °C |
| Punt d'ebullició | −33 °C (a 760 Torr) |
| Entropia molar estàndard | 192,5 J/mol·K |
| Entalpia estàndard de formació | -45,94 kJ/mol |
| Pressió de vapor | 8,5 atm (a 68 °F) |
| Perills | |
| Límit inferior d'explosivitat | 15 % |
| Límit superior d'explosivitat | 28 % |
| Dosi letal mínima | 5.000 ppm (ésser humà, mamífers, inhalació, 5 min) 1.500 mg/m³ (ésser humà, inhalació, 30 min) 5.000 ppm (mamífers, inhalació, 5 min) 3.317 ppm (ratolí de laboratori, inhalació, 1 h) 132 mg/kg (ésser humà) |
| Dosi letal mediana | 7 g/m³ (gat, conill, inhalació, 1 h) 4.600 mg/m³ (ratolí de laboratori, inhalació, 2 h) 4.500 ppm (ratolí de laboratori, inhalació, 1 h) 4.230 ppm (ratolí de laboratori, inhalació, 1 h) 21.430 ppm (ratolí de laboratori, inhalació, 30 min) 7 g/m³ (conill, inhalació, 1 h) 18.600 mg/m³ (rata de laboratori, inhalació, 5 min) 7.040 mg/m³ (rata de laboratori, inhalació, 30 min) 2.000 ppm (rata de laboratori, inhalació, 4 h) 17.401 ppm (rata de laboratori, inhalació, 15 min) 9.500 ppm (rata de laboratori, inhalació, 1 h) 40.300 ppm (rata de laboratori, inhalació, 10 min) 28.595 ppm (rata de laboratori, inhalació, 20 min) 20.300 ppm (rata de laboratori, inhalació, 40 min) 11.590 ppm (rata de laboratori, inhalació, 1 h) 7.338 ppm (rata de laboratori, inhalació, 1 h) 4.837 ppm (ratolí de laboratori, inhalació, 1 h) 9.859 ppm (conill, gat, inhalació, 1 h) 2.000 ppm (rata de laboratori, inhalació, 1 h) |
| Temperatura d'autoignició | 651 °C |
| Límit d'exposició promig ponderat en el temps | 18 mg/m³ (10 h, sense valor) 35 mg/m³ (8 h, Estats Units d'Amèrica) 25 ppm (, Egipte, Austràlia, Índia, Japó, Corea del Sud, Mèxic, Nova Zelanda, Noruega, Perú, Suècia, Turquia, Regne Unit) 20 ppm (, Àustria, Bèlgica, Dinamarca, Finlàndia, Alemanya, Islàndia) 14 mg/m³ (, Comissió Europea, Hongria, Països Baixos) 10 ppm (, França) 20 mg/m³ (, Polònia) 50 ppm (, Tailàndia, Filipines) |
| Límit d'exposició a curt termini | 27 mg/m³ (Polònia) 35 ppm (Austràlia, Índia, Corea del Sud, Mèxic, Nova Zelanda, Perú) 50 ppm (Bèlgica, Finlàndia, Islàndia, Suècia) 36 mg/m³ (Comissió Europea, Hongria) 20 ppm (França) 20 mg/m³ (Rússia) |
| IDLH | 210 mg/m³ i 300 ppm |
L'amoníac és un compost químic la molècula del qual consisteix en un àtom de nitrogen (N) i tres àtoms d'hidrogen (H) d'acord amb la fórmula NH3.[1]
La molècula no és plana, sinó que té la forma d'un tetràedre amb un vèrtex vacant. Això es deu a la formació d'orbitals híbrids sp3. En dissolució aquosa es pot comportar com una base i formar-se l'ió amoni, NH4+, amb un àtom d'hidrogen en cada vèrtex del tetràedre:
- NH3 + H2O ⇔ NH4+ + OH-
L'amoníac és un gas incolor d'olor molt penetrant. Es genera de forma natural pel medi ambient i també és manufacturat. Es dissol fàcilment en l'aigua i s'evapora ràpidament. Generalment es ven en forma líquida.[1]
La quantitat d'amoníac produït industrialment cada any és gairebé igual a la produïda per la naturalesa. L'amoníac és produït naturalment a terra per bacteris, per plantes i animals en descomposició i per rebuigs animals. L'amoníac és essencial per a molts processos biològics.[1]
La major part de l'amoníac produït en plantes químiques és usat per a fabricar adobs. La resta és usada en tèxtils, plàstics, explosius, a la producció de polpa i paper, aliments i begudes, productes de neteja domèstics, refrigerants i altres productes. També s'usa en sals aromàtiques.
Contingut
1 Síntesi
2 Aplicacions
3 Medi ambient
4 Efectes nocius
5 Referències
6 Enllaços externs
Síntesi
L'amoníac s'obté exclusivament pel procés Haber-Bosch, que consisteix en la reacció directa i catalitzada de nitrogen i hidrogen.
Estat d'oxidació del nitrogen en amoníac-3
Aplicacions
És molt usat en la refrigeració, en cicles de la compressió a causa de la seva alta calor de vaporització i temperatura crítica entre d'altres. També s'utilitza en processos d'absorció en combinació amb aigua.
L'amoníac i els seus derivats urea, nitrat d'amoni, etc. són usats en agricultura com a fertilitzant nitrogenat.
L'amoníac ocorre naturalment i és manufacturat també. És una font important de nitrogen que necessiten les plantes i els animals. Els bacteris que es troben als intestins poden produir amoníac.
L'amoníac gasós pot dissoldre's en aigua. Aquest tipus d'amoníac s'anomena amoníac líquid o solució d'amoníac. Una vegada que s'exposa a l'aire, l'amoníac líquid es transforma ràpidament en un gas.
L'amoníac s'aplica directament a terra en terrenys agrícoles, i s'usa per fabricar adobs per a collites agrícoles, prats i plantes.
Molts productes de neteja domèstics i industrials contenen amoníac.
Medi ambient
L'amoníac és fàcilment biodegradable, les plantes l'absorbeixen amb molta facilitat eliminant-lo del medi, de fet és un nutrient molt important per al seu desenvolupament. Encara que concentracions molt altes en l'aigua, com tot nutrient, pot causar greus danys en un riu o estany, ja que l'amoníac interfereix en el transport d'oxigen per l'hemoglobina.
Efectes nocius
L'exposició a altes concentracions d'amoníac en l'aire pot produir cremades greus a la seva pell, ulls, gola i pulmons.[1] En casos extrems pot ocórrer ceguesa, danys pulmonars i la mort. Respirar concentracions més baixes pot causar tos i irritació del nas i el coll.
Si una persona s'empassa amoníac pot patir cremades a la boca, la gola i l'estómac. Vessar amoníac concentrat sobre la pell causarà cremades. Els estudis en animals demostren efectes similars als observats en éssers humans. No se sap si l'amoníac afecta la reproducció en éssers humans.
Referències
↑ 1,01,11,21,3 «amoníac». L'Enciclopèdia.cat. Barcelona: Grup Enciclopèdia Catalana.
Enllaços externs
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Amoníac |
Agència per a substàncies tòxiques i el registre de malalties (EUA): Ressenya toxicològica. (Informació de domini públic). (anglès)
Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Fitxa internacional de seguretat química de l'amoníac. (castellà)