Punt de fusió
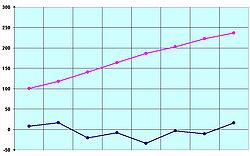
Punts de fusió (en blau) i punts d'ebullició (en rosat) dels vuit primers àcids carboxílics (°C).
El punt de fusió d'un material és la temperatura a la qual aquest material comença a canviar el seu estat de sòlid a líquid;[1] és a dir, és el punt en què les seves molècules adquireixen una mobilitat suficient per trencar els lligams elèctrics i s'escampen lliurement.
En química orgànica, la regla de Carnelley, establerta en 1882 per Thomas Carnelley, afirma que una simetria molecular elevada s'associa amb un alt punt de fusió,[2] basant-se en l'examen de 15.000 compostos químics. Un alt punt de fusió resulta d'un alt calor de fusió, una baixa entropia de fusió, o una combinació de tots dos. En les molècules altament simètriques la fase cristal·lina està densament poblada amb moltes interaccions intermoleculars eficients que ocasionen un canvi d'entalpia de fusió més alt en.
Quan considerem la temperatura del canvi invers, de líquid a sòlid, ens referim al "punt de congelació". A diferència del punt d'ebullició, el punt de fusió és independent de la pressió.[3]
Exemples
Aigua: 273 K (0 °C)
Mercuri: 234,32 K (-38,83 °C)
Grafit: 4.241 K (3.948 °C) (és el material amb el punt de fusió més alt)
Coure: 1.357,6 K (1.081,45 °C)
Referències
↑ Ramsay, J. A. «A new method of freezing-point determination for small quantities». J. Exp. Biol., 26, 1, 1949, pàg. 57–64. PMID: 15406812.
↑ «Melting Point and Molecular Symmetry». Journal of Chemical Education, 77, 6, 2000, pàg. 724. Bibcode: 2000JChEd..77..724B. DOI: 10.1021/ed077p724.
↑ Tonkov, E. Yu. and Ponyatovsky, E. G. (2005) Phase Transformations of Elements Under High Pressure, CRC Press, Boca Raton, p. 98 ISBN 0-8493-3367-9
Vegeu també
- Congelació
- Estat de la matèria
- Punt triple
