Nitrat
| Substància | oxoanió i monoanion |
|---|---|
| Massa molecular | 61,988 uma |
| Estructura química | |
| Fórmula química | NO₃⁻ |
SMILES canònic | Model 2D [N+](=O)([O-])[O-] |
| InChI | Model 3D |
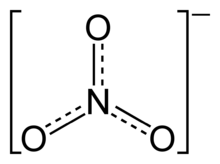
L'ió nitrat
En química inorgànica, un nitrat és un ió derivat per descomposició de l'àcid nítric, format per un àtom de nitrogen i tres d'oxigen (NO3-). El radical nitrat ·NO3 té un electró desaparellat que el fa molt reactiu, sobretot en l'atmosfera. En química orgànica s'anomenen nitrats als èsters de l'àcid nítric i diversos alcohols. El nitrat dels aliments, especialment en els vegetals, es converteixen en l'aparell digestiu humà en nitrit, que reacciona amb les amines per a formar nitrosamines carcinogèniques.
Contingut
1 Estructura
2 Identificació
3 Reactivitat
4 Nitrats en hortalisses
4.1 Quantitats de nitrats trobades
5 Referències
6 Vegeu també
Estructura
Està centrat en el nitrogen i presenta tres formes resonants que el donen una energia de deslocalització extra que el fan estable en un ampli rang de temperatures.[1]
La forma de Lewis és plano-trigonal.
Estructura de Lewis
Identificació
Els intermedis radicals de les reaccions són més fàcils d'identificar a través d'espectres d'absorció òptica. El radical nitrat, ·NO3, va ser obtingut d'aquesta manera fa 100 anys, en 1881, tot sent la primera espècie radicalària detectada fotoquímicament. Amb l'entrada del segle XX, es va fer més evident la importància d'aquesta espècie en diferents reaccions en l'estratosfera i troposfera de la Terra.[2]
Reactivitat
En l'atmosfera, se'n forma a partir de la següent reacció:
NO2 + O3 → ·NO3+ O2
Tant a l'estratosfera com la troposfera per la dissociació del N2O5
N2O5 + M → ·NO3+ NO2 + M
Els processos fotoquímics són claus per la reactivitat dels radicals. Durant el dia, el NO3 pateix fotòlisis segons la longitud d'ona de la llum que li arribi:[3]
·NO3+ hv → ·NO + O2·NO3+ hv → ·NO2 + O
Al canvi, en la troposfera la reactivitat és més complexa per la presència de múltiples compostos orgànics. Habitualment és el radical hidroxil l'encarregat d'atacar a aquestes espècies durant el dia, però el radical nitrat és l'agent oxidant més important en la troposfera durant la nit. Alguns compostos com CH3SCH3 o terpens es troben influenciats per la química diürna amb el ·OH[4]
Hi ha dues maneres d'iniciar els processos: per abstracció d'un hidrogen del compost orgànic o per l'addició d'un enllaç insaturat per formar un radical més complex.
·NO3 + RH → HNO3 + R
·NO3 + >C=C< → >C(ONO2)C·<
Per aquests processos la concentració relativa ·NO3 predomina durant la nit, tot arribant de mitjana 109 molècules.cm-3 fins a baixar a primeres hores del matí, quan comença a predominar ·OH Amb concentracions relatives de 106 molècules.cm-3.
Nitrats en hortalisses
Els nitrats es troben de forma natural en els vegetals especialment en les hortalisses de fulla verda com els espinacs, les bledes i els enciams. La llum afavoreix el metabolisme dels vegetals i limita l'acumulació de nitrats en ells, per això els espinacs d'hiverns tenen més contingut de nitrats que els espinacs d'estiu i els d'hivernacle més que els de l'aire lliure. Els nitrats són poc tòxics però sí que ho són els nitrits que es formen dins del cos humà a partir dels nitrats ingerits. L'emmagatzemament, en males condicions (temperatura ambient) de vegetals amb nitrats pot portar a la conversió in situ dels nitrats en nitrits. Els nitrits a altes concentracions poden originar metahemoglobinèmia, i la corresponent cianosi (síndrome del nadó blau). A la Unió Europea el Reglament 1881/2006 estableix el nivell de contaminants màxims en certs aliments. En infants es considera que el contingut de nitrats en les fulles d'enciams no representen perill però s'hauria de controlar el consum d'espinacs en els menors de 7 anys.[5]
Quantitats de nitrats trobades
Segons l'EFSA, organisme sanitari de la Unió Europea, ha determinat les quantitats presents d'aquest compost en aliments:[6] A més s'ha de tenir en compte que els continguts de nitrats en espinacs frescos són més elevats que en els congelats.
Bledes 1.690 mg/kg
Remolatxa hortícola 1.379 mg/kg
Enciam 1.324 mg/kg (enciam iceberg 875 mg/kg)
Api 1.103 mg/kg
Espinacs 1.066 mg/kg
Carbassó 416 mg/kg
Mongeta tendra 323 mg/kg
Pastanaga 296 mg/kg
Cogombre 185 mg/kg
Patata 168 mg/kg
Ceba 164 mg/kg
Pebrot 108 mg/kg
Tomàquet 43 mg/kg
Pèsol 30 mg/kg
Referències
↑ book.iupac.org/R05066.html IUPAC Recommendations 1995: Glossary of class names of organic compounds and reactivity intermediates based on structure. Pág. 1362
↑ NELSON, DAVID L. (DAVID LEE), 1942-; COX, MICHAEL M. Lehninger principles of biochemistry. 5th ed. New York : Freeman, cop. 2008
↑ CHORKENDORFF, I (IB), 1955-.; NIEMANTSVERDRIET, J. W.Concepts of modern catalysis and kinetics. Weinheim : Wiley-VCH,cop. 2003
↑ VANLOON, GARY W.; DUFFY, STEPHEN J. Environmental chemistry : a global perspective. 3rd ed. Oxford : Oxford University Press, 2011
↑ http://www.aesan.msc.es/AESAN/docs/docs/rincon_consumidor/Recomendaciones_nitratos.pdf
↑ EFSA Journal number, 689;1-79
Vegeu també
- Mines de nitre de Humberstone i Santa Laura
Viccionari