Sulfat d'amoni
| Substància | compost químic |
|---|---|
| Massa molecular | 132,02 uma |
| Estructura química | |
| Fórmula química | H₈N₂O₄S |
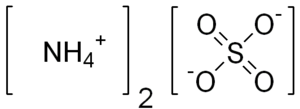 | |
SMILES canònic | Model 2D N.N.OS(=O)(=O)O |
| InChI | Model 3D |
| Propietats | |
| Densitat | 1,769 g/cm³ (a 20 °C) |
| Punt de descomposició | 218 °C |
| Entalpia estàndard de formació | -1.180 kJ/mol |
El sulfat d’amoni (antigament sulfat amònic) és un compost químic de fórmula (NH4)2SO4, amb molts usos comercials, l'ús principal és com a fertilitzant en agricultura. Té un 21% de nitrogeni un 24% de sofre. La seva aplicació tracta de reduir el pH del sòl en els sòls de tendència alacalina.
Contingut
1 Usos
2 Preparació
3 Referències
4 Bibliografia
Usos
A més de com fertilitzant és un coadjuvant en insecticides, herbicides, i fungicides amb la funció d’enllaçar el ferro i calci de l’aigua i les cèl·lules de les plantes, en això és particularment útil en l’herbicida glifosat.
It is also used in the preparation of other ammonium salts.
En bioquímica, la precipitació del sulfat d’amoni és un mètode comú per purificar proteïnes. Per això és un ingredient de vacunes.[1]
També és un additiu alimentari.[2][3]
En solució saturada en aigua pesant (D2O) és una solució estàndard en espectroscopia.
També s’ha fet servir com retardant de flama.[4]
Amb sulfat d’amoni es poden fabricar explosius i en alguns casos està prohibit tenir-ne (per exemple a l’Afganistan l’any 2010)
Preparació
El sulfat d’amoni es fabrica reaccionat amoni sintètic o subproductes d’amoni dels forns de coc amb àcid sulfúric:[5]
- 2 NH3 + H2SO4 → (NH4)2SO4
També es fa sulfat amònic a partir del guix (CaSO4•2H2O).:
(NH4)2CO3 + CaSO4 → (NH4)2SO4 + CaCO3
En la natura apareix rarament en el mineral mascagnita en fumaroles volcàniques.[6]
Referències
↑ Pink Book | Appendix B: Vaccine Excipient & Media Summary, Part 2
↑ Panera Bread › Menu & Nutrition › Nutrition Information Profile
↑ Official Subway Restaurants U.S. Products Ingredients Guide
↑ George, C.W.; Susott, R.A. «Effects of Ammonium Phosphate and Sulfate on the Pyrolysis and Combustion of Cellulose». Research Paper INT-90. USDA Forest Service, abril 1971.
↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
↑ http://www.mindat.org/min-2584.html/ Mindat data
Bibliografia
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Sulfat d'amoni |
- Properties: UNIDO and International Fertilizer Development Center (1998), Fertilizer Manual, Kluwer Academic Publishers, ISBN 0-7923-5032-4.