Taula periòdica

Imatge de la taula periòdica dels elements químics
La taula periòdica és una representació esquemàtica mitjançant la disposició en una graella o taula dels elements químics, ordenats per nombre atòmic creixent i de forma que s'hi reflecteix la llei periòdica formulada per Dmitri Mendeléiev, això és, la semblança dels elements químics cada cert nombre de nombres atòmics.
D'aquesta manera, s'agrupen els elements en:
- 4 blocs segons les seves configuracions electròniques (bloc s, bloc p, bloc d i bloc f),
- 7 períodes (fileres),
- 18 grups o famílies (columnes), amb propietats físiques i químiques molt similars (per exemple: grup dels halògens, grup dels gasos nobles...),
- 10 sèries o grups d'elements amb propietats semblants però més generals que les famílies.
La primera taula periòdica fou concebuda pel químic rus Dmitri Mendeléiev el 1869[1] i per l'alemany Julius Lothar von Meyer el 1870[2] de manera independent. Gràcies a la distribució que realitzà, Mendeléiev pogué predir l'existència d'elements químics encara no descoberts (gal·li, germani...) i les propietats físiques (punt de fusió, densitat, color...) i químiques (massa atòmica, compostos, reactivitat química amb l'aire, l'aigua, els àcids, les bases...) que tindrien. El seu aïllament es realitzà poc després (el gal·li el 1875, el germani el 1886...) i es confirmaren les prediccions fetes pel químic rus, la qual cosa donà un fort suport a la seva taula periòdica.
Posteriorment, la taula periòdica original de Mendeléiev s'hagué de modificar per incloure grups d'elements que no havien estat predits (gasos nobles, lantànids) o que se sintetitzaren en laboratoris perquè no existeixen en la natura (actínids), donant lloc a la taula periòdica actual. La figura següent és una taula periòdica moderna, la versió oficial de la IUPAC, amb els elements químics coneguts.
Metalls alcalins | Alcalinoterris | Lantànids | Actínids | Metalls de transició |
Metalls del bloc p | Metal·loides | No metalls | Halògens | Gasos nobles |
Grup | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
Període | ||||||||||||||||||||
1 | 1 H | 2 He | ||||||||||||||||||
2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||||
3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||||
4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr | ||
5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe | ||
6 | 55 Cs | 56 Ba | * | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn | ||
7 | 87 Fr | 88 Ra | ** | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Nh | 114 Fl | 115 Mc | 116 Lv | 117 Ts | 118 Og | ||
| * Lantànids | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | |||||
| ** Actínids | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr | |||||
Codificació de colors dels nombres atòmics dels elements:
- En blau són líquids a temperatura i pressió estàndard (TPE);
- En verd, són gasos a TPE;
- En negre, són sòlids a TPE;
- En vermell, són sintètics (tots són sòlids a TPE);
Contingut
1 Estructura
2 Periodicitat de les configuracions electròniques
3 Propietats periòdiques atòmiques
3.1 Radi atòmic
3.2 Volum atòmic
3.3 Energia de ionització
3.4 Electroafinitat
3.5 Electronegativitat
4 Propietats periòdiques físiques
5 Propietats periòdiques químiques
5.1 València
5.2 Caràcter metàl·lic
6 Història
6.1 Tríades de Döbereiner
6.2 El caragol tel·lúric
6.3 Les octaves de Newlands
6.4 La taula de Mendeléiev
6.5 Posteriors ampliacions
7 Altres formats
8 Extensió
9 Any Internacional UNESCO 2019
10 Referències
11 Bibliografia
12 Enllaços externs
Estructura
Grup 2 | |
Període | |
2 | 4 Be |
3 | 12 Mg |
4 | 20 Ca |
5 | 38 Sr |
6 | 56 Ba |
7 | 88 Ra |
En la taula periòdica, els elements s'ordenen per ordre creixent de nombre atòmic i en files (en horitzontal), de manera que els elements que tenen propietats químiques i físiques semblants queden situats en les mateixes columnes (en vertical). Les files d'elements, les anomenen períodes i n'hi ha 7, numerats de l'1 al 7 començant per la part superior. No tots tenen el mateix nombre d'elements: el període 1 en té 2, l'hidrogen i l'heli; els períodes 2 i 3 en tenen 8 cadascú; els períodes 4 i 5 en tenen 18 cadascú; i els períodes 6 i 7 en tenen 32 cadascú.
Grup | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Període 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr |
A les columnes, hi queden les famílies o grups d'elements semblants. N'hi ha 18 numerades de l'1 al 18 començant per l'esquerra. Algunes famílies tenen nom propi com el grup 1 (alcalins), el 2 (alcalinoterris), el 16 (calcògens), el 17 (halògens) i el 18 (gasos nobles). Igual que passa amb els períodes, tampoc tenen el mateix nombre d'elements: el grup 1 i el 18 en tenen 7; els grups 2, 13, 14, 15, 16 i 17 en tenen 6; els grups del 4 al 12 en tenen 4; i el grup 3 en té 32 (s'hi inclouen els 14 lantànids i els 14 actínids, que tots són molts semblants a l'element que els dóna nom, el lantani i l'actini, respectivament).
Tanmateix, hi ha l'hidrogen, que està situat amb el grup dels alcalins, a l'esquerra, i no comparteix propietats amb aquests; de fet, són completament diferents. La raó d'aquesta posició de l'hidrogen és que comparteix configuració electrònica amb la resta d'alcalins.
Periodicitat de les configuracions electròniques

Configuracions electròniques dels diferents blocs
Si comparam les configuracions electròniques dels elements amb la taula periòdica, ens adonem que cada període comença amb l'addició d'un electró en un nou nivell energètic, no ocupat prèviament. Així, l'hidrogen i els elements del grup 1 tenen una configuració electrònica ns1, en què n és el nombre quàntic principal del darrer nivell, o el més extern. Aquest nivell normalment s'anomena nivell o capa de valència perquè és el que caracteritza químicament l'element.
Els elements dels grups 1 i 2 (a la figura 1A i 2A), els alcalins i alcalinoterris, tenen configuracions ns1 i ns2, respectivament, i ambdós grups s'anomenen elements del bloc s. Els grups del 13 al 18 (a la figura 3A a 8A) tenen configuracions de ns2np1 a ns2np6, respectivament, i s'anomenen elements del bloc p. La configuració del nivell de valència ns2np6 correspon als gasos nobles i és especialment estable, com es dedueix de les seves baixes reactivitats.
Els elements dels grups 3 al 12 (a la figura 3B a 8B i 1B i 2B) s'anomenen elements o metalls de transició o elements del bloc d. Cada una de les sèries horitzontals d'aquests elements correspon a l'ocupació tardana del subnivell d del nivell (n-1) d'aquests àtoms. Com qualsevol subnivell d pot acollir 10 electrons, hi ha 10 elements per a cada nivell (4, 5 i 6) d'aquest bloc.
Finalment, queda el bloc f constituït pels lantànids i actínids que van ocupar els 14 orbitals f del nivell (n-2).
Així es veu que amb la taula periòdica es pot predir la configuració electrònica de la majoria d'elements químics.
Propietats periòdiques atòmiques

Taula periòdica amb el radi atòmic dels elements
Radi atòmic
El radi atòmic és la distància entre el nucli i els electrons més externs.
- En un grup, creix en augmentar el nombre atòmic Z. El radi augmenta dins d'un grup perquè el darrers electrons, els electrons de valència, estan cada vegada més allunyats del nucli. Intervenen diferents factors: el primer factor és que dins d'un grup, en baixar els electrons, ocupen cada vegada nivells d'energia més alts i, per tant, més allunyats del nucli, la qual cosa dóna lloc a un augment del radi atòmic. En part, aquest augment es compensa amb l'increment de la càrrega nuclear. Els àtoms que estan més avall tenen una càrrega nuclear més elevada que els que estan per damunt i, segons la llei de Coulomb, l'atracció a la qual estan sotmesos els electrons és major, cosa que fa que s'aproximin al nucli disminuint el radi. Però aquest segon factor es veu en part compensat per un tercer factor, l'efecte d'apantallament dels electrons interiors, els quals repel·leixen els electrons exteriors i redueixen l'efecte d'atracció del nucli. En conjunt, aquests tres factors donen que el radi atòmic augmenti considerablement en davallar dins d'un grup i els elements que estan situats a la part inferior de la taula periòdica tinguin radis majors.
- En un període, disminueix en augmentar Z. En aquest cas intervenen només dos factors: el primer és que els electrons més externs estan situats tots en el mateix nivell, la qual cosa fa que el radi no variï. El segon factor és l'augment de la càrrega nuclear que es produeix en avançar dins d'un període. Això produeix una contracció dels àtoms i una disminució del seu radi. Els electrons interns produeixen apantallament, però per a tots els àtoms és el mateix, ja que els nivells ocupats sempre són els mateixos i no és un factor determinant.[3][4]
Volum atòmic

Volum atòmic en funció de la massa atòmica
El volum atòmic és l'espai que ocupa un àtom.
- En un grup, augmenta en augmentar el nombre atòmic Z. La causa, la trobam perquè dins d'un grup en baixar cada vegada hi ha ocupats nivells més alts d'energia que estan més allunyats del nucli. Això fa que els àtoms tenguin un volum major. Hi ha un factor que s'oposa a aquest augment i és l'augment de càrrega nuclear que fa que l'atracció electroestàtica sigui més elevada en baixar dins d'un grup. Però part d'aquesta atracció es veu compensada per l'apantallament, la repulsió dels electrons més interns.
- En un període passa el mateix que amb el radi, és a dir, disminueix en augmentar Z. La causa, la trobam perquè els electrons ocupen el mateix nivell energètic i en avançar en el període la càrrega nuclear augmenta. Per això, l'atracció electroestàtica sobre els electrons augmenta i el volum es redueix.[3][4]
Energia de ionització

Energies de ionització dels elements
L'energia de ionització és l'energia que cal subministrar a un àtom en el seu estat fonamental i gasós per a arrancar-li un electró. Per al primer electró, s'anomena primera energia de ionització, per a segon, 2a energia de ionització i així successivament. La ionització d'un element X es pot representar per:
X→X++e−{displaystyle Xrightarrow X^{+}+e^{-}}
- En un grup disminueix en augmentar el nombre atòmic Z. A la figura adjunta, s'observa clarament amb els gasos nobles (els màxims) o amb els alcalins (els mínims). La causa d'aquesta variació és que, si bé en baixar dins d'un grup, la càrrega nuclear és major i, en principi, l'atracció electroestàtica també ho és, la posició dels electrons de la darrera capa és cada vegada més allunyada del nucli i això fa que l'atracció electroestàtica, segons la llei de Coulomb, sigui menor, ja que és inversament proporcional a la distància entre càrregues (protons del nucli-electró més extern). També s'ha de considerar la repulsió dels electrons interns, l'apantallament, que redueix l'atracció del nucli. Amb tot això, les energies de ionització disminueixen en baixar dins d'un grup, per tant els àtoms que se situen a la part més baixa de la taula periòdica són més fàcilment ionitzables.
- En un període creix en augmentar Z. Quan s'avança dins d'un període augmenta el nombre de protons i, per tant, la càrrega nuclear, produint una atracció electroestàtica major sobre els electrons. Contràriament al que passa dins d'un grup, tots els electrons més externs en un període ocupen la mateixa capa i, per això, se situen d'entrada a distàncies semblants del nucli i amb la major càrrega nuclear s'aproximen més a aquest. Així, els electrons més externs estan més propers al nucli, la qual cosa implica major atracció electroestàtica i, també, la càrrega nuclear és major, per tant també major atracció. En conseqüència, les energies de ionització augmenten considerablement dins d'un període com s'observa a la figura. El darrer element del període, el gas noble, és el que té l'energia de ionització major. Després hi ha una baixada en omplir-se un altre nivell energètic i allunyar-se el darrer electró del nucli.[3][4]
Electroafinitat
Electroafinitat o afinitat electrònica és l'energia que desprèn un àtom en el seu estat fonamental i gasós quan guanya un electró i passa a ser un anió. Podem representar-ho per la següent equació corresponent a la ionització d'un element X:
X+e−→X−{displaystyle X+e^{-}rightarrow X^{-}}
- En un grup disminueix en augmentar el nombre atòmic Z, ja que els nous electrons se situen en orbitals cada vegada més allunyats del nucli on l'atracció electroestàtica del nucli és més feble per la llei de Coulomb.
- En un període creix en augmentar Z perquè la càrrega nuclear augmenta en avançar en un període i els electrons se situen en el mateix nivell, per tant cada vegada més propers al nucli i més atrets.[3][4]
Electronegativitat

Electronegativitat de Pauling
Electronegativitat és la capacitat que té un àtom per a atreure els electrons de l'enllaç covalent que forma amb un altre àtom, és a dir, tendència que presenta un àtom a compartir desigualment els electrons de l'orbital o els orbitals del seu enllaç. Hom ha convingut d'acceptar com a valor de l'electronegativitat d'un element el valor que aquest agafa en combinar-se amb l'hidrogen. L'escala d'electronegativitats fou calculada per primera vegada per Linus Pauling[5][6] a partir dels moments dipolars, electroafinitats i potencials de ionització, bo i donant com a valor patró 4,0 per al fluor. L'electronegativitat és emprada en fórmules empíriques per a calcular el caràcter iònic d'un enllaç i també per a calcular de manera aproximada la longitud d'enllaç a partir de la longitud dels radis covalents.
- En un grup disminueix en augmentar Z, ja que si bé augmenta la càrrega nuclear també augmenten els nivells ocupats i els darrers electrons, els que formen els enllaços estan més allunyats del nucli en davallar a la taula periòdica.
- En un període creix en augmentar Z, ja que augmenta la càrrega nuclear efectiva per l'augment del nombre de protons i els electrons se situen tots en el mateix nivell. Els elements químics situats a la dreta de la taula periòdica són els més electronegatius exceptuant-ne els gasos nobles.
Propietats periòdiques físiques
Les propietats físiques dels elements químics varien seguint la llei periòdica. Propietats com el punt de fusió, el punt d'ebullició, la conductivitat tèrmica, la conductivitat electrònica, la duresa i la densitat mostren variacions periòdiques amb el nombre atòmic. Sovint la variació no és tan regular com la que es produeix amb les propietats periòdiques atòmiques, perquè la relació d'aquestes propietats físiques i la configuració electrònica no és directa.
Com a exemples, es poden citar la densitat i els punts de fusió. Ambdues propietats es poden representar respecte al nombre atòmic, i s'hi observa una successió de màxims i mínims. En el cas de la densitat, els mínims corresponen als metalls alcalins i augmenta en davallar dins del grup. En el cas dels punts de fusió, els mínims corresponen als gasos nobles, i també augmenten els punts de fusió en davallar dins del grup.[3]
Propietats periòdiques químiques
Les propietats periòdiques químiques són les que empraren Mendeléiev i Meyer per a descobrir la llei periòdica. A continuació se'n detallen algunes:
València
La valència d'un element indica quina és la seva capacitat de combinació amb altres elements. Per exemple, amb molt poques excepcions, un àtom d'hidrogen es combina com a màxim amb un àtom d'un altre element. Així podem trobar molècules com H2, HF, HCl i H2O. Es diu que l'hidrogen té valència 1.
Tanmateix, un àtom d'oxigen es combina amb dos àtoms d'hidrogen per donar la molècula de l'aigua, H2O. Un àtom de nitrogen es combina amb tres àtoms d'hidrogen per donar la molècula d'amoníac, NH3. Un àtom de carboni es combina amb quatre àtoms d'hidrogen per formar la molècula de metà, CH4. Per tant, es diu que l'oxigen, el nitrogen i el carboni tenen valències 2, 3 i 4, respectivament.
La valència dels elements és una propietat periòdica, ja que tots els elements d'un grup tenen la mateixa valència.
| Període 1 | H | He | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Període 2 | Li | Be | B | C | N | O | F | Ne | |
| Període 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |
| València | 1 | 2 | 3 | 4 | 3 | 2 | 1 | 0 | |
Per exemple, tots els alcalins tenen valència 1; tots els alcalinoterris tenen una valència 2, tots els gasos nobles tenen valència 0, tots els halògens tenen valència 1, etc. Així, els òxids, per exemple, dels elements del grup 14, tenen fórmules iguals: CO2, SiO2, GeO2, etc.
També s'observa una regularitat en un període que es representa a la taula adjunta. Si deixam a part els elements dels blocs d i f, i només ens fixam en els dels blocs s i p (grups 1 i 2 i del 13 al 18), s'observa que la valència s'incrementa en una unitat en passar d'un element a l'altre, fins a arribar a un màxim, en l'element del grup 14, i després es redueix d'unitat en unitat fins als gasos nobles (0). L'explicació d'aquest fet és molt simple: els elements del mateix grup de la taula periòdica tenen el mateix nombre d'electrons en la seva capa de valència.[4]
Caràcter metàl·lic
El caràcter metàl·lic està relacionat amb les propietats físiques i químiques dels elements. Aquest caràcter disminueix a mesura que ens desplacem cap a la dreta per un període, i per això el caràcter dels primers grups és molt més elevat que el dels darrers.
Metalls de transició
Enmig de la taula periòdica, entre els grups 2 i 13, hi ha 10 grups anomenats metalls de transició. Reben aquest nom perquè el formen elements metàl·lics amb propietats que varien gradualment d'esquerra a dreta. Els més importants són el ferro i el coure.
Lantànids i actínids
Al peu de la taula hi ha dues grans famílies, la família dels lantànids i la família dels actínids. S'anomenen així perquè comencen amb el lantà i amb l'actini, respectivament. Els elements que formen cada família tenen entre si propietats molt semblants, per això s'agrupen i s'estudien conjuntament. S'inclouen en el grup dels metalls.
Elements artificials
Els elements compresos entre l'element 93 (neptuni) i el final, juntament amb els elements de nombre atòmic 43 (el tecneci) i 61 (el prometi), són elements artificials, és a dir, que no existeixen pràcticament en la natura i que s'han obtingut al laboratori per transmutació nuclear.
Metalls
- La majoria dels elements són metàl·lics.
- Els metalls tendeixen a perdre electrons.
- Tots són sòlids a temperatura ordinària, excepte el mercuri i el franci, que són líquids.
- Des del punt de vista físic, els metalls presenten lluïssor metàl·lica, són mal·leables (es poden reduir a làmines molt fines) i dúctils (se'n poden fer fils per estirament).
- Són bons conductors de l'electricitat i de la calor.
- La densitat dels metalls és molt variable.
- Molt sovint s'utilitzen els metalls purs, ja que s'obtenen propietats més riques i interessants en forma d'aliatges.
No metalls
- Formen una àmplia varietat de compostos, tant amb els metalls com entre si.
- N'hi ha que, a temperatura ordinària, són gasos, com l'hidrogen, l'oxigen, el nitrogen, el fluor i el clor; el brom és líquid i la resta són sòlids.
- Cap no és bon conductor de l'electricitat o de la calor, ni tampoc cap no té lluïssor metàl·lica.
- Els elements no metàl·lics tendeixen a guanyar electrons.
Metal·loides o semimetalls
- Són semiconductors, ja que només condueixen l'electricitat en determinades condicions.
- Presenten lluïssor metàl·lica.
- Entre els semimetalls hi ha el silici i el germani, components bàsics en la fabricació de transistors.
Història
Tríades de Döbereiner
| Element | Massa molar (g/mol) | Densitat (g/cm³) |
|---|---|---|
| Clor | 35.453 | 0.0032 |
| Brom | 79.904 | 3.1028 |
| Iode | 126.904 | 4.933 |
| Calci | 40.078 | 1.55 |
| Estronci | 87.62 | 2.54 |
| Bari | 137.327 | 3.594 |
Un químic alemany, Johann Wolfgang Döbereiner, es va adonar que alguns elements químics devien guardar certa relació. L'any 1817, va mostrar que la massa atòmica de l'estronci era aproximadament igual al valor mitjà de les masses atòmiques del calci i del bari, elements químicament anàlegs a l'estronci:
ASr≈ACa+ABa2=40,1+137,32=88,7{displaystyle A_{Sr}approx {frac {A_{Ca}+A_{Ba}}{2}}={frac {40,1+137,3}{2}}=88,7}
La densitat també era una propietat que complia aproximadament la mateixa regla. El 1829,[7] va mostrar l'existència de més grups de tres elements anomenats tríades de Döbereiner, que formaven compostos de composició similar i amb propietats semblants: sofre, seleni i tel·luri; clor, brom i iode; liti, sodi i potassi. L'any 1850, els químics havien aconseguit identificar al voltant de 20 tríades, que indicaven entre els elements una certa regularitat.
El caragol tel·lúric
El 1862,[8] el francès Alexander Emile Beguyer de Chancourtois construí la seva Vis tellurique, en la qual els elements estaven situats per ordre creixent de masses atòmiques en una hèlix al voltant d'un cilindre vertical, de manera que els elements que quedaven els uns sota els altres tenien propietats semblants. Això ho aconseguí fent que la diferència de masses atòmiques en cada volta fos de 16 unitats. Però als químics del seu temps no els semblà un diagrama útil i va rebre poca atenció.
Les octaves de Newlands
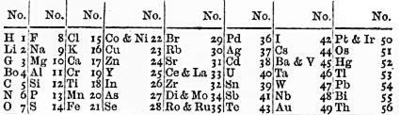
Octaves de Newlands
El 1864,[9][10][11] un químic anglès, John Newlands, va descobrir que en ordenar els elements segons la seva massa atòmica, sense comptar amb l'hidrogen i tampoc l'heli, que encara no s'havia descobert, el vuitè element (sodi) tenia propietats similars al primer (liti), el novè (magnesi) al segon (beril·li) i, així successivament, cada vuit elements, les propietats es repetien. Ho va anomenar llei de les octaves,[12] recordant els períodes musicals. Però les octaves de Newlands deixaven de complir-se després del clor.
La taula de Mendeléiev

Taula periòdica de Mendeléiev (1871)
El 1869,[1]Mendeléiev va publicar el que es considera la primera taula periòdica. Havia ordenat els elements seguint la seva massa atòmica. No va fixar el període de repetició de propietats, sinó que el va ampliar a mesura que augmentava el pes atòmic. Va invertir l'ordre d'alguns elements perquè encaixessin les seves propietats amb les dels elements adjacents, i va deixar forats, indicant que corresponien a elements encara no trobats. La taula periòdica actual manté l'estructura proposada per Mendeléiev, però canviant files per columnes.
Paral·lelament, el 1870,[2] el químic alemany Lothar Meyer estudiava els elements de manera gràfica, representant el volum de cada àtom en funció del seu pes, obtenint una gràfica en ones cada vegada majors. Fou el descobriment de la llei periòdica, però va arribar un any massa tard.
Posteriors ampliacions
El descobriment dels gasos nobles, elements desconeguts per Mendeléiev, obligà a cercar-los lloc en la taula periòdica. Així, William Ramsay proposà el 1897[13] la creació d'un nou grup d'elements després dels halògens, el grup 18, el dels gasos nobles.
L'any 1945, Glenn Seaborg demostrà l'existència del grup dels actínids, molts dels quals, els transurànids, sintetitzà amb els seus col·laboradors durant la primera meitat del segle XX. Segons Seaborg, els actínids havien de formar un grup com ho feien els lantànids i per sota d'aquests, separats dels metalls de transició del bloc d amb els quals havien estat agrupats inicialment.[14]

Johann Wolfgang Döbereiner

Alexandre-Émile Béguyer de Chancourtois

John Alexander Reina Newlands

Dmitri Mendeléiev

Julius Lothar von Meyer
Altres formats
Diferents científics han proposat altres formats de la taula periòdica sense abandonar l'ordenació per ordre creixent de nombre atòmic, algunes de les quals figuren a continuació. Algunes permeten visualitzar millor la llei periòdica d'algunes propietats, però només són emprades per una minoria de científics. La taula periòdica d'ús generalitzat és la que s'ha descrit en aquest article i és l'oficial de la IUPAC.

Espiral de Theodor Benfey (1960)

Bucle de James Franklin Hyde

De Timmothy Stowe

De Charles Janet (1929) i Tarantola (2000)

Espiral homeopàtica de Jan Scholten

De Emil Zmaczynski & Thomas Bayley

ADOMAH de Valery Tsimmerman

Una variant moderna del vis tel·lúric de Chancourtois
Extensió
La taula periòdica original només té 118 elements i set períodes; si es descobreixen nous elements posteriorment, se situen al vuitè i probablement al novè, dos períodes addicionals que s'exposen a ser més llargs que el setè. Això es deu al només calculat bloc g, el qual conté 18 elements parcialment omplerts amb orbitals atòmics del tipus g.
8 | 119 Uue | 120 Ubn | 121 Ubu | 122 Ubb | 123 Ubt | 124 Ubq | 125 Ubp | 126 Ubh | 127 Ubs | 128 Ubo | 129 Ube | 130 Utn | 131 Utu | 132 Utb | 133 Utt | 134 Utq | 135 Utp | 136 Uth | 137 Uts | 138 Uto | 139 Ute | 140 Uqn | 141 Uqu | 142 Uqb | 143 Uqt | 144 Uqq | 145 Uqp | 146 Uqh | 147 Uqs | 148 Uqo | 149 Uqe | 150 Upn | 151 Upu | 152 Upb | 153 Upt | 154 Upq | 155 Upp | 156 Uph | 157 Ups | 158 Upo | 159 Upe | 160 Uhn | 161 Uhu | 162 Uhb | 163 Uht | 164 Uhq | 165 Uhp | 166 Uhh | 167 Uhs | 168 Uho |
9 | 169 Uhe | 170 Usn | 171 Usu | 172 Usb | 173 Ust | 174 Usq | 175 Usp | 176 Ush | 177 Uss | 178 Uso | 179 Use | 180 Uon | 181 Uou | 182 Uob | 183 Uot | 184 Uoq | 185 Uop | 186 Uoh | 187 Uos | 188 Uoo | 189 Uoe | 190 Uen | 191 Ueu | 192 Ueb | 193 Uet | 194 Ueq | 195 Uep | 196 Ueh | 197 Ues | 198 Ueo | 199 Uee | 200 Bnn | 201 Bnu | 202 Bnb | 203 Bnt | 204 Bnq | 205 Bnp | 206 Bnh | 207 Bns | 208 Bno | 209 Bne | 210 Bun |
Llegenda
- Uue - Ununenni
- Ubn - Unbinili
- Ubu - Unbini
- Ubb - Unbibi
- Ubt - Unbitri
- Ubq - Unbiquadi
- Ubp - Unbipenti
- Ubh - Unbihexi
- Ubs - Unbisepti
- Ubo - Unbiocti
- Ube - Unbienni
- Utn - Untrinili
- Utu - Untrini
- Utb - Untribi
- Utt - Untritri
- Utq - Untriquadi
- Utp - Untripenti
- Uth - Untrihexi
- Uts - Untrisepti
- Uto - Untriocti
- Ute - Untrienni
- Uqn - Unquadnili
- Uqu - Unquaduni
- Uqb - Unquadbi
- Uqt - Unquadtri
- Uqq - Unquadquadi
- Uqp - Unquadpenti
- Uqh - Unquadhexi
- Uqs - Unquadsepti
- Uqo - Unquadocti
- Uqe - Unquadenni
- Upt - Unpenttri
- Upq - Unpentquadi
- Upp - Unpentpenti
- Uph - Unpenthexi
- Ups - Unpentsepti
- Upo - Unpentocti
- Upe - Unpentenni
- Uhn - Unhexnili
- Uhu - Unhexuni
- Uhb - Unhexbi
- Uht - Unhextri
- Uhq - Unhexquadi
- Uhp - Unhexpenti
- Uhh - Unhexhexi
- Uhs - Unhexsepti
- Uho - Unhexocti
- Uhe - Unhexenni
- Usn - Unseptnili
- Usu - Unseptuni
- Usb - Unseptbi
- Ust - Unsepttri
- Usq - Unseptquadi
- Usp - Unseptpenti
- Ush - Unsepthexi
- Uss - Unseptsepti
- Uso - Unseptocti
- Use - Unseptenni
- Uon - Unoctnili
- Uou - Unoctuni
- Uob - Unoctbi
- Uot - Unocttri
- Uoq - Unoctquadi
- Uop - Unoctpenti
- Uoh - Unocthexi
- Uos - Unoctsepti
- Uoo - Unoctocti
- Uoe - Unoctenni
- Uen - Unennili
- Ueu - Unennuni
- Ueb - Unennbi
- Uet - Unenntri
- Ueq - Unennquadi
- Uep - Unennpenti
- Ueh - Unennhexi
- Ues - Unennsepti
- Ueo - Unennocti
- Uee - Unennenni
- Bnn - Binilnili
- Bnu - Biniluni
- Bnb - Binilbi
- Bnt - Biniltri
- Bnq - Binilquadi
- Bnp - Binilpenti
- Bnh - Binilhexi
- Bns - Binilsepti
- Bno - Binilocti
- Bne - Binilenni
- Bun - Biunnili
Any Internacional UNESCO 2019
L'any 2019 ha estat proclamat Any Internacional de la Taula Periòdica dels Elements Químics per la UNESCO.
Referències
↑ 1,01,1 Mendeléiev, D. «On the Relationship of the Properties of the Elements to their Atomic Weights» (en anglès). Zeitschrift für Chemie, 12, 1869, pàg. 405-406.
↑ 2,02,1 Meyer, J.l. «Die Natur der chemischen Elemente als Function ihrer Atomgewichte» (en anglès, traducció). Annalen der Chemie, Supplementband, 7, 1870, pàg. 354-364.
↑ 3,03,13,23,33,4 Russell, J.B.. Química general. McGraw-Hill, 1980. ISBN 968-451-412-1.
↑ 4,04,14,24,34,4 Gillespie, R.J.; 'et al.'. Química (I) (en castellà). 1a ed.. Barcelona: Reverté, 1990. ISBN 84-291-7187-8.
↑ Pauling, L. The nature of the chemical bond. Ithaca, New York: Cornell University Press, 1960.
↑ Pauling, L. General chemistry. san Francisco: Freeman, 1970.
↑ Döbereiner, J.W. «An Attempt to Group Elementary Substances according to Their Analogies» (en anglès, traducció). Poggendorf's Annalen der Physik und Chemie, 5, 1829, pàg. 301-307.
↑ Beguyer de Chancourtois, A.E. «Sur un classement naturel des corps simples ou radicaux appelé vis tellurique» (en francès). Comptes rendus, 757, 1863.
↑ Newlands, J.A.R. «On Relations among the Equivalents» (en anglès). Chemical News, 7, 1863, pàg. 70-72.
↑ Newlands, J.A.R. «Relations between Equivalents» (en anglès). Chemical News, 10, 1864, pàg. 59-60.
↑ Newlands, J.A.R. «On Relations Among the Equivalents» (en anglès). Chemical News, 10, 1864, pàg. 94-95.
↑ Newlands, J.A.R. «On the Law of Octaves» (en anglès). Chemical News, 12, 1865, pàg. 83.
↑ Ramsay, W. «An Undiscovered Gas» (en anglès). Nature, 56, 1897, pàg. 378-382.
↑ Seaborg, G.T. «The Chemical and Radioactive Properties of Heavy Elements» (en anglès). Chemical and Engineering News, 23, 1945, pàg. 2190-2193.
Bibliografia
Agafoshin, N.P.; Beltrán, J. Ley periódica y sistema periódico de los elementos de Mendeleiev. Reverté, 1977. ISBN 8429170219.
Bravo, L.A.. Tabla periódica en espiral y propiedades zonales. Reverté, 1978. ISBN 8429170618.
Cooper, D.G.. La tabla periódica. Reverté, 1976. ISBN 842917138X.
Emsley, J. Nature's building blocks: an A-Z guide to the elements. Oxford University Press US, 2001. ISBN 0198503415.
Hofmann, S. On beyond uranium: journey to the end of the periodic table. Taylor & Francis, 2002. ISBN 0415284953.
Mendeléiev, D.I.. La Regularitat periòdica dels elements químics. Institut d'Estudis Catalans, 2008. ISBN 978-84-7283-962-5.
Mendeléiev, D.I.. La Relació entre les propietats dels elements i llur pes atòmic. Institut d'Estudis Catalans, 2005. ISBN 8472837971.
Polo, R. Mendeleiev. Nivola, 2008. ISBN 9788496566934.
Scerri, E.R.. The periodic table: its story and its significance. Oxford University Press US, 2007. ISBN 0195305736.
Strathern, P. El sueño de Mendeléiev. De la alquimia a la química. Siglo XXI de España Editores, 2000. ISBN 8432310468.
Enllaços externs
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Taula periòdica |
Taula periòdica: taula periòdica interactiva.
Webelements: informació de tots els elements de la taula periòdica (en anglès).
Llista dels elements i traducció a diverses llengües.
Edu365: elements químics: pàgina web amb informació de tots els elements i informació general sobre aquests. També hi ha una secció d'entreteniments.
Periodic Table Formulations: pàgina web en què hi ha una relació exhaustiva de diferents formats de la taula periòdica (anglès).
Taula periòdica.
Taula periòdica dels elements segons la seva abundància natural relativa.















