Oxidani
| Substància | catió i compost químic |
|---|---|
| Massa molecular | 19,01839 uma |
| Estructura química | |
| Fórmula química | H₃O⁺ |
 | |
SMILES canònic | Model 2D [OH3+] |
| InChI | Model 3D |
| Propietats | |
| Acidesa (pKa) | 0 |
L'oxidani o oxoni, antigament anomenat hidroni, és el catió derivat de la coordinació d’un protó, H+{displaystyle {ce {H^+}}} , sobre l’oxigen de l’aigua, H2O{displaystyle {ce {H2O}}}, la qual fórmula és H3O+{displaystyle {ce {H3O^+}}}. Existeix en les solucions aquoses dels àcids, fortament associat amb altres molècules d'aigua; la vida mitjana d'un ió individual és de 10-13 s. Té una estructura molecular de piràmide triangular aplanada, amb un angle H−O−H{displaystyle {ce {H-O-H}}} de 115°. El nom oxoni és emprat com a base per als seus productes de substitució.
Contingut
1 Nomenclatura
2 Estructura
3 Àcids i acidesa
4 Derivats
5 Bibliografia
6 Referències
Nomenclatura

Representació molecular de l'ió oxidani
D'acord amb la nomenclatura de les regles del 2005 de la Unió Internacional de Química Pura i Aplicada (IUPAC), aquest catió s'anomena oxidani si s'empra la nomenclatura de substitució, i oxoni amb la nomenclatura de composició o estequiomètrica. L'antic nom hidroni no és actualment acceptat per la IUPAC.[1]
Estructura
L'estructura de l'oxidani és de piràmide trigonal, disposant-se cadascun dels quatre àtoms en els vèrtexs. Les mesures en fase gas indiquen que la longitud dels enllaços O-H són de 0,961 Å, i l'angle H-O-H és de 114,7°; n dissolució els valors són diferents, la longitud O-H és de 1.002 Å i l'angle H-O-H106,7°. Pertany al grup de simetria C3v. H3O+ té un radi iònic de 0,100 nm, sensiblement inferior al radi molecular de l'aigua, H2O, (0,138 nm). El seu volum molar és de -5.4 cm3 mol-1.[2]
L'estructura pot sofrir inversions, de la mateixa manera que un paraigües amb el vent, amb una energia d'activació inferior a la d'un enllaç d'hidrogen i això pot passar com a alternativa, o fins i tot preferida, a la rotació dins d'un clúster dinàmic d'unió d'hidrogen. Tots els ions d'hidrogen es formen a partir d'un "nucli" H3O+. No són estructures fixes en dissolució aquosa, sinó que existeixen com a cúmuls "parpellejants", com en altres raïms d'aigua, amb molècules d'aigua que uneixen hidrogen contínuament. Les vides de les agrupacions són independents de la vida dels enllaços individuals. No obstant això, les diferències energètiques entre els diferents tipus del clúster en la solució aquosa són petites i les interconversions tenen lloc fàcilment.[2]
Àcids i acidesa
L'oxidani és el catió que es forma en l'aigua en presència de cations d'hidrogen H+{displaystyle {ce {H^+}}}. Aquests cations no es presenten lliurement; són extremadament reactius i són solvatats immediatament per les molècules d'aigua circumdants. Generalment s'anomena acid a qualsevol compost que sigui font d'aquests cations; però com l'aigua és amfòtera, l'oxidani es presenta fins i tot en aigua pura on la seva concentració és de CH+ = 10–7M.
L'oxidani és molt àcid; a 25 °C, el seu pKa = –1,7. L'acidesa de l'oxidani és l'estàndard implícit a l'hora de mesura l'acidesa d'altres espècies químiques.
El pH d'una dissolució és la mesura de la concentració dels protons; com que els protons reaccionen amb l'aigua per donar ions oxidani, es pot considerar el pH com la concentració d'aquesta última espècie química.
Derivats
Els seus derivats s'anomenen oxonis.[3] Exemples de derivats:
- metiloxoni: [CH3OH2]+{displaystyle {ce {[CH3OH2]^+}}}o [MeOH2]+{displaystyle {ce {[MeOH2]^+}}}
- etiloxoni: [CH3CH2OH2]+{displaystyle {ce {[CH3CH2OH2]^+}}}o [EtOH2]+{displaystyle {ce {[EtOH2]^+}}}
- trimetiloxoni: [(CH3)3O]+{displaystyle {ce {[(CH3)3O]^+}}}o [Me3O]+{displaystyle {ce {[Me3O]^+}}}
Les sals d'alquiloxoni es fan servir com agents alquilatants.[4] També es fan servir per per preparar èters enol i grups funcionals relacionats.[5][6]
 | 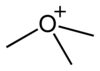 |  |  |
| model general piramidal dels ions oxoni | fórmula esquelètica del catió de trimetiloxoni | model de bolles i enllaços del trimetiloxoni | model de bolles del trimetiloxoni |
Bibliografia
- Wicke, E.; Eigen, M. & Ackermann, Th. (1954) Über den Zustand des Protons (Hydroniumions) in wäßriger Lösung. Z. Phys. Chem., 1, 340-364.
- Marx, D.; Tuckerman, M. E.; Hutter, J. & Parrinello, M. (1999) The nature of the hydrated excess proton in water. Nature, 397, 601-604.
- Zavitsas, A. A. (2001) Properties of water solutions of electrolytes and nonelectrolytes. J. Phys. Chem. B, 105, 7805-7815.
- Hulthe, G.; Stenhagen, G.; Wennerström, O. & C-H. Ottosson, C-H. (1997) Water cluster studied by electrospray mass spectrometry, J. Chromatogr. A, 512, 155-165.
- Zundel, G. & Metzger, H. (1968) Energiebänder der tunnelnden Übershuß-Protenon in flüssigen Säuren. Eine IR-spektroskopische Untersuchung der Natur der Gruppierungen H5O2+ Z. Phys. Chem., 58, 225-245.
Referències
↑ Chemistry, International Union of Pure and Applied. Nomenclature of Inorganic Chemistry: IUPAC recommendations 2005 (en en). Royal Society of Chemistry, 2005. ISBN 9780854044382.
↑ 2,02,1 martin.chaplin@btinternet.com, martin chaplin:. «Hydrogen ions». [Consulta: 12 gener 2018].
↑ International Union of Pure and Applied Chemistry. «IUPAC Gold Book - oxonium ions» (en en). DOI: 10.1351/goldbook.O04378. [Consulta: 12 gener 2018].
↑ Douglas J. Raber, Patrick Gariano, Jr, Albert O. Brod, Anne L. Gariano, And Wayne C. Guida "Esterification Of Carboxylic Acids With Trialkyloxonium Salts: Ethyl And Methyl 4-acetoxybenzoates" Org. Synth. 1977, volume 56, 59.doi:10.15227/orgsyn.056.0059
↑ Justin R. Struble And Jeffrey W. Bode "Synthesis Of A N-mesityl Substituted Aminoindanol-derived Triazolium Salt" Org. Synth. 2010, volume 87, 362 doi:10.15227/orgsyn.087.0362
↑ Lous S. Hegedus, Michael A. Mcguire, And Lisa M. Schultze "1,3-Dimethyl-3-methoxy-4-phenylazetidinone" Org. Synth. 1987, volume 65, 140.doi:10.15227/orgsyn.065.0140
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Oxidani |




![{displaystyle {ce {[CH3OH2]^+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e8b9f0a31b20a75d4be60479eeab3fbc06acb06)
![{displaystyle {ce {[MeOH2]^+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/48537930d09e753f81cfb4537f670176a5aa442a)
![{displaystyle {ce {[CH3CH2OH2]^+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/43a138b66e2c82e4ab50811a3eebf980707d0256)
![{displaystyle {ce {[EtOH2]^+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a3abae5894814cc5940cf060cf33d46a71f07c19)
![{displaystyle {ce {[(CH3)3O]^+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bdf64972d86dd84d5e8b27a2909ee295fd8884df)
![{displaystyle {ce {[Me3O]^+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/74ebaf26226edc206c0dcdca1ea83efcada5b80f)