Alcà
| Substància | classe estructural de compostos químics |
|---|---|
Els alcans són molècules orgàniques formades per la unió covalent d'un nombre variable de carbonis units a àtoms d'hidrogen. Els alcans es caracteritzen per no presentar dobles enllaços com ara els alquens o alquins, de manera que també poden anomenar-se hidrocarburs saturats, ja que contenen el nombre màxim d'àtoms d'hidrogen que poden unir-se amb la quantitat d'àtoms de carboni presents en cada molècula. La seva fórmula respon a CnH2n+2 per aquells que presenten una estructura lineal (alcans alifàtics) o amb ramificacions i a la fórmula CnH2n per aquells alcans que adopten una estructura cíclica, denominats cicloalcans.
Els alcans no presenten adherit cap mena de grup funcional, cosa que determina la seva poca reactivitat en comparació amb altres compostos orgànics com podrien ser aquells que contenen els grups funcionals carbonil (-CO), carboxil (-COOH), amida (CONH2)... i explica el seu nom d'origen llatí: parafines, que significa poca afinitat.
L'alcà més senzill és el metà, amb un sol àtom de carboni unit a quatre d'hidrogen. Altres alcans coneguts són l'età, el propà o el butà, amb dos, tres i quatre àtoms de carboni respectivament. A partir de cinc carbonis, els noms deriven de numerals grecs: pentà, hexà, heptà...
En la següent taula s'il·lustra l'estructura molecular d'alguns alcans.
| C | Nom | Fórmula | Model |
|---|---|---|---|
| 1 | Metà | CH4 |  |
| 2 | Età | C2H6 | 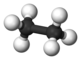 |
| 3 | Propà | C3H8 |  |
| 4 | n-Butà | C4H10 | |
| 5 | n-Pentà | C5H12 | |
| 6 | n-Hexà | C6H14 | |
| 7 | n-Heptà | C7H16 | |
| 8 | n-Octà | C8H18 |  |
| 9 | n-Nonà | C9H20 |  |
| 10 | n-Decà | C10H22 | |
| 11 | n-Undecà | C11H24 | |
| 12 | n-Dodecà | C12H26 |  |
Contingut
1 Nomenclatura
1.1 Alcans lineals
1.2 Alcans ramificats
1.3 Radicals derivats dels alcans
1.4 Cicloalcans
1.5 Halogenurs d'alquil
2 Propietats físiques dels alcans
2.1 Punt d'ebullició
2.2 Punt de fusió
2.3 Densitat
2.4 Polaritat dels alcans
2.5 Solubilitat
2.6 Conductivitat elèctrica
2.7 Geometria molecular dels alcans
2.8 Conformacions
3 Isòmers dels alcans
4 Propietats químiques dels alcans
4.1 Reaccions d'oxidació-reducció dels alcans
4.2 Cracking
4.3 Isomerització i reformat d'alcans
4.4 Altres reaccions
5 Anàlisi dels alcans
6 Aplicacions dels alcans
6.1 Alcans en estat gasós o líquid molt volàtil
6.2 Alcans en estat líquid volàtil
6.3 Alcans en estat líquid
6.4 Alcans en estat sòlid
7 Presència d'alcans en l'univers
8 Abundància dels alcans a la Terra
9 Importància dels alcans en fongs i plantes
10 Importància dels alcans en animals
11 Relacions ecològiques, en les quals els alcans juguen una importància clau
12 Riscos i perills dels alcans
12.1 Perills del metà
12.2 Descomposició d'alcans, metanògens
12.3 Acció del metà sobre el canvi climàtic
12.4 Butà, risc per combustió incompleta
12.5 Hexà, heptà, nonà i dodecà.
12.6 Hidrocarburs no cremats
13 Fonts industrials d'alcans
14 Utilitats del petroli
15 Producció d'alcans
15.1 Refinat de petroli
15.2 Preparació d'alcans en el laboratori
16 Bibliografia
Nomenclatura
Alcans lineals
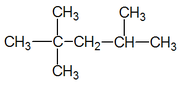
Els alcans lineals que segueixen al butà (4 carbonis) s'anomenen amb el prefix indicador del nombre de carbonis seguit de la terminació -à. El prefix n- s'utilitza per a qualsevol alcà, per llarg que sigui, en el qual tots els carbonis formen una cadena contínua sense ramificacions.
Alcans ramificats
Igual que els alcans lineals, són compostos de carboni i hidrogen formats per enllaços covalents, per compartició d'un parell d'electrons, entre els orbitals sp3 en el cas de l'enllaç carboni-carboni i sp3 del carboni amb s de l'hidrogen en els enllaços carboni-hidrogen. La fórmula molecular dels alcans ramificats és CnH2n+2, on n representa el nombre d'àtoms de carboni. Així doncs, veiem que l'únic que diferencia un alcà lineal d'un altre, amb el mateix nombre de carbonis però amb ramificacions, és la conformació a l'espai, se'ls denomina isòmers, ja que responen a la mateixa fórmula molecular.
Les normes a l'hora d'anomenar els alcans ramificats més complexos estan determinades pel sistema IUPAC (International Union of Pure and Applied Chemistry) establert per diversos comitès i comissions en representació dels químics del món.
Per a anomenar-los s'ha de seleccionar la cadena més llarga numerant els seus carbonis de manera que el primer substituent (ramificació) tingui el menor índex possible, si els substituents estan situats a igual distància dels àtoms de carboni terminals, tindrà prevalença el més senzill. A l'hora d'anomenar els grups que formen les ramificacions s'ha de dir quants i on estan inserits, anomenant els substituents acabats en -il i per ordre alfabètic.
Radicals derivats dels alcans
Els radicals derivats dels alcans (alquils) s'anomenen substituint la terminació -à per -il. Aquests radicals s'enumeren a partir del carboni que es troba unit a la cadena principal, de manera que aquest serà l'1. La fórmula general per un grup alquil és CnH2n+1, ja que conté un hidrogen menys que l'alcà d'estructura lineal que té el mateix nombre de carbonis. Aquest últim respon a l'estructura CnH2n+2.
Així, doncs, l'età, per exemple, respon a l'estructura C2H6, ja que cada carboni s'uneix amb l'altre i amb tres hidrogens. L'etil, però, respon a la fórmula C2H5, de manera que el carboni número 1 s'uneix al carboni de la cadena principal, al segon carboni de l'etil i a dos hidrògens, mentre que el segon carboni es troba unit a tres hidrògens.
El prefix n- sempre s'emplea per indicar un grup alquil els carbonis del qual formen una sola cadena contínua i el punt d'enllaç amb la cadena principal de la qual és el carboni de l'extrem.
En aquesta estructura s'observen units en el segon i el quart carboni de la cadena principal, grups metil -CH3, es tracta dels alquils més senzills.
Els noms com ara iso-, sec-, terc- i neo-, són noms no sistemàtics, és a dir, aquests no respecten les regles de la IUPAC, tot i això, es reconeixen com a vàlids (sempre que l'estructura no superi els 6 àtoms de carboni) ja són noms bastant utilitzats i difosos arreu de la literatura.
- Així com es fa servir el terme isoalcà per a designar un compost, de sis carbonis o menys, en el que tots ells, excepte un, formen una cadena contínua i el carboni que no forma part de la cadena principal està unit a aquesta a partir del seu penúltim carboni, el prefix iso- s'usa també per a designar un grup alquil que té una sola ramificació monocarbonada en el penúltim carboni de la cadena i presenta el punt d'unió a la cadena principal de l'alcà en l'extrem oposat d'aquesta.
- El prefix sec- s'utilitza quan el primer carboni de l'alquil presenta una ramificació monocarbonada.
- També s'utilitza el prefix Terc- o Neo-, aquest últim l'utilitzarem per a parlar d'un alquil en el qual trobem un carboni unit a quatre carbonis més, o el que és el mateix, un alquil amb dues ramificacions en el penúltim carboni de la cadena principal de l'alquil.
CH3−C−(C|CH3CH3|H2)n−CH3{displaystyle {ce {mathsf {C{overset {displaystyle quad CH_{3} atop |}{underset {| atop displaystyle quad CH_{3}}{H_{3}-C-(C}}}H_{2})n-CH_{3}}}}}
Aquesta molècula representa un neo-alcà
Cicloalcans
Els cicloalcans formen cadenes tancades o anells. Es classifiquen en monocíclics si consten d'un sol anell i policíclics si en tenen dos o més.
- Els monocíclics es troben constituïts per un sol cicle i s'anomenen de la mateixa manera que els alcans lineals però afegint el prefix ciclo- davant el nom de la molècula lineal d'igual nombre de carbonis (ciclopropà, ciclobutà, ciclopentà, ciclohexà....)
Hidrocarburs amb anells enllaçats (policíclics)
En trobem que tenen els anells iguals i s'anomenen biciclo- triciclo-... La posició relativa dels anells i els substituents s'indica amb l'ajuda de localitzadors, un exemple d'aquesta nomenclatura seria l'1,1'-biciclopropà.
En altres que tenen anells diferents s'agafa com a referència el major i els altres s'anomenen com substituents ordenats alfabèticament.
Els espirocompostos són compostos bicíclics amb un àtom de carboni comú a ambdós anells, s'anomenen avantposant la paraula espiro seguida, entre claudàtors, del nombre d'àtoms de carboni a una i altra banda del carboni espirànic, de menor a major finalitzant amb el nom de l'alcà amb igual nombre de carbonis que el total, seria el cas de l'espiro [3,4] octà, per exemple.
Existeixen també compostos políciclics fusionats: Són hidrocarburs policíclics amb dos o més àtoms de carboni comuns a dos o més anells. S'anomenen avantposant el prefix biciclo, triciclo... al nom de l'alcà amb igual nombre de carbonis i intercalant entre claudàtors el nombre de carbonis, de major a menor, que hi ha entre els àtoms de carboni comuns. Seria el cas del biciclo[2.2.1]heptà. Alguns dels noms no sistemàtics que poden adoptar responen a la geometria del compost i són per exemple: l'adamantà, el cubà, el prismà o el triasterà.
Halogenurs d'alquil
Cal esmentar també, per la seva importància, els halogenurs d'alquils, que es denominen haloalcans. A l'hora d'anomenar-los, es tracta l'halogen com si fos una cadena lateral; anomenem primer l'alcà com si no tingués l'halogen i afegim a continuació fluor, clor, brom o iode, juntament amb els números i prefixos que siguin necessaris.
Propietats físiques dels alcans
Aquesta taula mostra la variació dels valors d'aquestes propietats físiques en funció del nombre de carbonis de l'alcà (en l'eix horitzontal, nombre d'àtoms de carboni dels 14 primers alcans).

En blau marí figuren els punts de fusió i en rosa els punt d'ebullició d'alguns alcans en funció del seu nombre de carbonis (en l'eix vertical, temperatura —en graus Celsius— dels punts de fusió i ebullició).
Punt d'ebullició
La interacció entre molècules apolars es deu a forces de Van der Waals, que són de naturalesa dèbil. El fet que aquestes actuïn entre les superfícies moleculars explica que com major sigui una molècula i en conseqüència la seva superfície, més intenses siguin les forces intermoleculars. D'altra banda, el nombre d'electrons que envolten la molècula, cosa que determina també la intensitat de les interaccions intermoleculars, s'incrementa amb la massa molecular de l'alcà. Això explica que els punts de fusió i ebullició augmentin a mesura que creix el nombre de carbonis en la molècula. De fet el punt d'ebullició augmenta de 20 a 30 graus per a cada carboni que s'agrega a la cadena.
Els alcans amb ramificacions tenen un punt d'ebullició una mica més baix que els seus isòmers lineals, a més, el punt d'ebullició disminueix a mesura que augmenta el nombre de ramificacions. Així, l'n-butà bull a -0.5 °C, i l'issobutà ho fa a -12 °C; l'n-pentà té un punt d'ebullició de 36 °C; l'isopentà amb una ramificació, 28 °C, i el neopentà amb dues, 9.5 °C. L'efecte que exerceixen les ramificacions d'aquestes molècules sobre els punts d'ebullició de la substància es deu al fet que, en presència de ramificacions, la forma de la molècula tendeix a aproximar-se a la d'una esfera, amb la qual cosa disminueix la seva superfície i en conseqüència s'afebleixen les interaccions entre les molècules, podent ésser superades a temperatures inferiors.
D'altra banda els cicloalcans tendeixen a tenir punts d'ebullició majors que les corresponents molècules lineals. Això és a causa de les conformacions fixes que adquireixen les molècules, que proporcionen plans per al contacte intermolecular, fent així que aquestes interaccions intermoleculars esdevinguin més intenses i més difícils d'ésser vençudes.
Punt de fusió
El punt de fusió dels alcans segueix la mateixa tendència que el seu punt d'ebullició, pel que fa a l'augment d'aquest a mesura que augmenta el nombre de carbonis de la molècula de l'alcà i per tant la seva superfície i les forces de Van der Waals s'intensifiquen. Tot i això, però, el punt de fusió també es veu alterat per l'estructura cristal·lina adoptada, de manera que els alcans amb nombre de carbonis imparell posseeixen punts de fusió una mica inferiors als esperats. Això es deu al fet que els alcans de longitud parell s'empaqueten bé en la fase sòlida, formant una estructura ben organitzada, que requereix major energia per a rompre's; en canvi l'empaquetament més desordenat dels alcans de longituds imparell requereix menys energia per a trencar-se.
Els punts de fusió dels alcans de cadena ramificada, sol disminuir, també, a mesura que augmenta el nombre de ramificacions i amb conseqüència disminueix la superfície a causa del seu reordenament. Tot i això aquesta tendència es veu alterada en funció de la facilitat de l'alcà en qüestió per a empaquetar-se bé en la fase sòlida, de manera que és possible trobar alcans ramificats amb temperatures de fusió superiors a les dels seus isòmers d'estructura lineal.
El punt de fusió d'alcans amb estructura cíclica és també major que la corresponent a l'alcà d'estructura lineal i mateix nombre de carbonis, degut probablement a la seva major rigidesa i simetria.
Aquestes característiques expliquen que a temperatura ambient els quatre primers alcans siguin gasos, els tretze següents (C5-C17) siguin líquids, i els alcans que presenten 18 àtoms de carboni o més, siguin sòlids.
Densitat
Com major és el nombre de carbonis de l'alcà, les forces intermoleculars són majors i la cohesió intermolecular augmenta, resultant en un augment de la proximitat molecular i, per tant, de la densitat. Tot i això, la densitat dels alcans tendeix a anivellar-se entorn de 0,8 de manera que tots són menys densos que l'aigua; de fet quasi tots els compostos orgànics són menys densos que l'aigua, ja que igual que els alcans, estan formats bàsicament per carbonis i hidrògens. En general perquè una substància sigui més densa que l'aigua, les molècules que la formen han de contenir almenys un àtom pesat com ara el brom, el iode o varis com el clor. En conseqüència, en una mescla entre alcà i aigua, l'alcà constituirà la capa superior.
Polaritat dels alcans
La molècula d'un alcà, ja sigui lineal, ramificada o cíclica, només presenta enllaços covalents. Aquests enllaços poden unir dos àtoms iguals, en l'enllaç per compartició d'un parell d'electrons degut al solapament frontal de dos orbitals sp3 de dos carbonis, enllaç que no presenta cap mena de polaritat; o bé enllaçar un àtom de carboni amb un d'hidrogen, l'electronegativitat dels quals no és molt diferent i que per tant pràcticament tampoc aporta polaritat a l'enllaç. S'ha de tenir en compte, també, que la molècula és molt simètrica, cosa que fa que les dèbils polaritats s'anul·lin amb facilitat.
Solubilitat
Així doncs, tenint en compte que semblants dissolen a semblants, els alcans no es dissoldran en aigua a causa del fet que aquesta és un dissolvent polar. L'aigua no estableix ponts d'hidrogen amb les molècules d'alcans; de fet, la coexistència d'un alcà i aigua condueix a un increment de l'ordre molecular o sigui, una disminució de l'entropia del sistema. Aquesta propietat es deu al fet que les interaccions entre les molècules d'aigua s'intensifiquen, ja que romanen allunyades de les molècules d'alcans, que són hidròfobes i que per tant també s'interrelacionen entre elles. Els alcans seran solubles en dissolvents orgànics, que són de naturalesa apolar. Trobem, doncs, que els diferents alcans seran miscibles entre si, cosa plausible en la majoria de compostos formats per alcans i d'interès per a l'home que es troben constituïts per mescles d'hidrocarburs, com ara la gasolina o el gas natural.
Conductivitat elèctrica
Els alcans són mals conductors del corrent elèctric, ja que no es polaritzen en presència d'un camp elèctric, a causa de la baixa dels electrons compartits en els enllaços covalents, ja que tendeixen a situar-se entre els dos nuclis.
Geometria molecular dels alcans
L'estructura molecular dels alcans afecta directament les seves estructures físiques i químiques.
La configuració electrònica del carboni 1s2 2s2 2p2 determina que per a formar-se enllaços amb les mateixes característiques s'hagi d'hibridar l'orbital 2s que té 2 electrons i els tres orbitals 2p, dos dels quals tenen un electró, per a formar 4 orbitals sp3 amb un electró cadascú. Aquests orbitals, que tenen energies idèntiques, estan orientats en l'espai formant un tetraedre, de manera que l'angle existent entre ells és aproximadament de 109.47°.
Per a formar alcans, aquest orbital sp3, s'encavalcarà amb un altre orbital de la mateixa naturalesa d'un altre carboni o amb un orbital 1s de l'hidrogen; el solapament d'aquests orbitals permetrà als dos àtoms que participen en l'enllaç compartir un parell d'electrons i, en el cas de l'hidrogen, adquirir una estructura estable o, en el cas del carboni, adquirir dita estructura després d'haver format un enllaç amb cadascun dels quatre orbitals sp3, compartint així quatre parells d'electrons i adquirint l'estabilitat característica de l'octet en la capa de valència.
Els enllaços carboni-hidrogen resulten del solapament de l'orbital s de l'hidrogen amb un orbital sp3 del carboni. Pel que fa als enllaços entre carbonis són producte de la compartició d'un parell d'electrons entre un orbital sp3 de cadascun dels carbonis. Ambdues superposicions d'orbitals s'efectuen de manera lineal. Es tracta d'enllaços sigma fort.
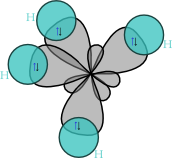
Els angles d'enllaç entre els carbonis o entre un carboni i un hidrogen no varien pràcticament en funció de l'alcà, si es tracta d'un hidrocarbur lineal i sense ramificacions. L'angle de l'enllaç carboni-hidrogen del metà és de 109.5º i la seva longitud de 1.1A (1,09×10−10 m). Així, doncs, els angles d'unió i longituds d'aquest enllaç en la resta d'hidrocarburs és semblant, com també ho és la longitud de l'enllaç entre dos carbonis. Aquesta longitud en l'età és de 1.53A (1,53×10−10m).

La disposició espacial dels enllaços és similar a la dels quatre orbitals sp3; estan disposats tetraèdricament, amb un angle de 109,47° entre ells. La fórmula estructural que representa els enllaços com si es trobessin en angles rectes, tot i esser comú i útil, no es correspon amb la realitat.
Conformacions
L'enllaç que uneix els àtoms de carboni és cilíndricament simètric respecte la línia d'unió d'ambdós nuclis de carboni; cosa que implica una lliure rotació entorn d'aquest enllaç de manera que es podran intercanviar una multitud de diferents ordenaments atòmics, anomenats conformacions.
Tot i això, certes propietats físiques de l'età indiquen que la rotació no és completament lliure, sinó que existeixen dues conformacions limitants importants, anomenades conformació eclipsada i conformació escalonada.
Els àtoms d'hidrogen, tant en el primer com en el segon carboni de la molècula, mantenen un angle de 120° entre ells, resultant de la projecció de la base del tetraedre en una superfície plana; l'angle de torsió entre un àtom d'hidrogen determinat del primer carboni i un altre àtom d'hidrogen del segon carboni pot variar entre 0° i 360°. Existeix, però, una conformació més estable, adoptada per la majoria de molècules en estat natural, consistent en la conformació escalonada, en la qual l'energia potencial de la molècula és mínima. La diferència energètica entre aquesta conformació i la menys estable, la conformació eclipsada, és de 3kcal/mol (12,6 KJ/mol). S'ha de tenir en compte, però, que aquesta barrera energètica no és molt intensa i que, fins i tot a temperatura ambient, la fracció de col·lisions que superen aquesta energia és bastant alta de manera que la interconversió de conformacions és ràpida. De fet, el temps requerit perquè una molècula d'età passi de la conformació escalonada a la següent equival a la rotació d'un grup CH3 de 120° en relació a un altre i requereix de l'ordre de 10−11segons.
L'energia que es requereix per a rotar la molècula d'età entorn de l'enllaç carboni-carboni o el que és el mateix la diferència energètica entre les dues conformacions limitants s'anomena energia torsional. La inestabilitat relativa de la conformació eclipsada es deu a la repulsió electrònica entre els núvols electrònics dels àtoms d'hidrogen, a causa del fet que es troben més pròxims entre si; per tant apareix, simultàniament també, repulsió estèrica entre els mateixos elements.

Representacions de Newman de la conformació eclipsada (esquerre) passant per estats intermedis fins a arribar a la conformació escalonada (situada a la dreta), també anomenades rotàmers.
El cas d'alcans majors és més complex, però es basa en els mateixos principis, amb la conformació antiperiplanar sent més favorable al voltant de cada enllaç carboni-carboni. Per aquesta raó, els alcans solen mostrar una disposició en zigazaga en els diagrames o en els models. L'estructura real sempre diferirà en algun aspecte d'aquestes formes idealitzades, perquè, un cop més, les diferències energètiques entre les conformacions són petites comparades amb l'energia tèrmica de les molècules; així doncs, les molècules dels alcans no tenen una estructura fixa, encara que els models així ho suggereixin.
A mesura que es reemplacen els hidrògens de l'età per altres àtoms o grups d'ells, apareixen altres factors que afecten l'estabilitat relativa de les conformacions: forces de Van der Waals, interaccions dipol-dipol, ponts d'hidrogen... tot i això la tendència dels orbitals d'enllaços sobre carbonis adjacents segueix essent de localitzar-se escalonadament, de manera que tota rotació que s'allunyi d'aquesta situació va acompanyada de tensió torsional.
Isòmers dels alcans
Dos compostos químics diferents amb la mateixa fórmula molecular es denominen isòmers. El nombre d'isòmers d'un alcà determinat dependrà del nombre d'àtoms de carboni presents en la molècula. Així, ni el metà, ni l'età, ni el propà poden presentar cap mena d'isòmers. Tot i això, a partir del butà, que pot presentar-ne dos, el nombre d'isòmers augmenta de forma brusca.
En aquesta taula s'il·lustra l'augment de possibles isòmers que pot posseir un hidrocarbur lineal i saturat en funció del seu nombre de carbonis.
Tot i compartir la fórmula molecular, els isòmers constitueixen substàncies diferenciades en les seves propietats físiques i químiques, per les diferents estructures que adopten, també en l'espai. De fet, cap moviment de torsió ni rotació entorn dels enllaços carboni-carboni pot fer coincidir la cadena lineal amb un dels seus isòmers ramificat, ja que en aquests hi ha almenys un carboni unit a altres tres, mentre que en la lineal cap carboni s'enllaça amb més de dos.
També es poden formar isòmers d'un alcà de cadena lineal de forma artificial; es tracta d'escalfar-los en presència d'un catalitzador de platí. En la isomerització els alcans es converteixen en els seus isòmers de cadena ramificada. En el procés de reformat, els alcans es converteixen en les seves formes cícliques o en hidrocarburs aromàtics, alliberant hidrogen com a subproducte. Ambdós processos eleven l'índex d'octà de la substància (explicat posteriorment)
Propietats químiques dels alcans
Com ja indica el nom antic de parafines, provinent del llatí: parum affinis, els alcans presenten una reactivitat baixa amb la majoria de compostos, ja que els seus enllaços de carboni són relativament estables i no poden ser fàcilment trencats. De fet en el petroli cru les molècules dels alcans poden romandre químicament sense canvis durant milions d'anys.
A diferència de molts altres compostos orgànics, no posseeixen grups funcionals i únicament reaccionen, i de manera pobra, amb substàncies iòniques o polars. La Ka dels alcans té valors inferiors a 60, en conseqüència, són pràcticament inerts als àcids i bases.
Tot i això, els alcans poden donar lloc a reaccions d'important rellevància, com són reaccions d'oxidació-reducció (mitjançant oxigen o halògens), piròlisis, nitracions, cracking, isomeritzacions... Els radicals lliures, molècules amb un nombre imparell d'electrons i, per tant, amb algun electró desaparellat, juguen un paper important en la majoria de les reaccions dels alcans, com són el cracking o el reformat, on els alcans de cadena llarga es converteixen en alcans de cadena curta i els alcans de cadena lineal esdevenen els seus isòmers ramificats respectivament.
A més els alcans interaccionen i s'uneixen a certs complexos de metalls de transició.
Reaccions d'oxidació-reducció dels alcans
Els àtoms de carboni dels alcans es troben fortament reduïts, especialment en el cas del metà, el carboni del qual presenta el menor estat d'oxidació possible (-4); així doncs, els alcans participaran en reaccions redox, particularment amb l'oxigen i els halògens.
La reacció amb l'oxigen condueix a la combustió sense fum, mentre que la reacció amb els halògens és una reacció de substitució.
En el cas dels alcans ramificats, l'angle de l'enllaç pot diferir significativament del valor òptim (109,47°), cosa que permet als diferents grups suficient espai. Aquesta situació provoca una tensió en la molècula coneguda com a impediment estèric que pot augmentar substancialment la seva reactivitat.
Reaccions amb l'oxigen (combustió)
Es tracta d'un procés exotèrmic, tot i que per a iniciar-se requereix una temperatura molt elevada. Així doncs, es requereix molta energia per a rompre els enllaços que generen les partícules reactives inicials, però un cop vençuda aquesta barrera energètica, els passos següents propagadors de la cadena procedeixen sense dificultat i amb l'evolució d'energia.
A altes temperatures els alcans es combinen amb l'oxigen en una reacció de combustió en la qual s'allibera diòxid de carboni, aigua i energia en forma de calor. Aquesta és la reacció bàsica de tots els hidrocarburs utilitzats com a combustible, font bàsica d'energia utilitzada per la humanitat.
A mesura que augmenta el nombre d'àtoms de carboni del compost es torna més difícil d'inflamar. Tot i això, l'equació general per a la combustió completa és:
CnH2n+2 + (1,5n+0,5)O2 → (n+1)H2O + nCO2 + E(calor).
En absència d'oxigen suficient, pot formar-se monòxid de carboni o sutge, com es mostra en la següent reacció:
CnH(2n+2) + ½ nO2 → (n+1)H2+ nCO
Per exemple l'oxidació del metà pot originar:
CH4 + 2O2 → CO2 + 2H2O
CH4 + O2 → C+ 2H2O
El canvi d'entalpia estàndard de combustió ΔcHº per als alcans s'incrementa aproximadament en 650 kJ/mol per a cada grup CH2 en una sèrie homòloga. Al mateix temps, els alcans de cadena lineal amb el mateix nombre de carbonis presenten valors majors de ΔcHº que els corresponents isòmers amb ramificacions, de manera que aquests són vistos com més estables.
- Reaccions amb halògens
Els alcans reaccionen amb halògens en la denominada reacció d'halogenació radicalària. Els àtoms d'hidrogen de l'alcà són reemplaçats progressivament por àtoms d'halogen. Els radicals lliures són les espècies que participen en la reacció, que generalment condueix a una mescla de productes. La reacció és altament exotèrmica i pot resultar en una explosió.
Aquestes reaccions són una important ruta industrial per als hidrocarburs halogenats.
Els experiments han demostrat que tota halogenació produeix una mescla de tots els isòmers possibles, indicant que tots els àtoms d'hidrogen són susceptibles de reaccionar. Tot i això, en la mescla resultant no s'hi troben en la mateixa proporció. De fet, com menor sigui l'energia d'enllaç, més fàcil i ràpida es produirà la substitució per un halogen. Aquesta selectivitat és major en el brom, però, que en el clor, ja que el brom és menys reactiu.
Aquesta substitució a l'atzar, en la pràctica és impossible de controlar. A més, els punts d'ebullició dels isòmers formats són tan pròxims que no es poden separar per destil·lació, cosa que fa que aquest mètode no pugui utilitzar-se per a obtenir compostos purs.
No obstant això, s'usa industrialment, ja que en moltes aplicacions la mescla resultant compleix amb el propòsit del procés, com és el cas de l'obtenció de mescles dissolvents o en certes matèries primeres.
Una mescla de clor i metà és perfectament estable en la foscor, però, si s'il·lumina amb llum solar, es produeix una reacció en cadena per substitució d'hidrògens per clor que adquireix caràcter explosiu. Aquesta reacció sensible a la llum és incontrolable i finalment condueix a la formació d'una mescla de di, tri i tetraclormetà en majors o menors proporcions depenent de la quantitat de clor disponible. El clor reacciona fotoquímicament, o per escalfament, de la mateixa manera amb altres alcans. El brom reacciona de manera similar, però amb menor violència i més selectivitat, mentre que el iode és molt poc reactiu. El fluor, que es troba en l'altre extrem de la reactivitat, reacciona de manera explosiva amb la majoria dels compostos orgànics.
Els halògens, doncs, reaccionen amb els alcans en el següent ordre: F2, >Cl2,> Br2 >I2.
Cracking
L'objectiu del cracking és la ruptura de molècules grans en unitats més petites. Aquesta operació pot realitzar-se per mitjà d'un mètode tèrmic o un mètode catalític.
La piròlisi (del grec: pyr, que significa foc, i lysis, que significa pèrdua) consisteix en la descomposició per calor d'una substància. La piròlisi d'alcans, en particular pel que fa al petroli, s'anomena cracking tèrmic, procés que segueix un mecanisme de reacció homolític amb formació de radicals lliures. En el cracking tèrmic, els alcans simplement es fan passar per una càmera escalfada a temperatures elevades: els alcans pesats es converteixen en alquens, alcans lleugers i hidrogen. Aquest procés produeix etilè (C2H4) en abundància i altres molècules petites.
En una modificació, anomenada cracking al vapor, es mesclen els hidrocarburs amb vapor, s'escalfen a 700-900 °C en una fracció de segon i es refreden ràpidament. Aquest procés està adquirint importància creixent en la producció d'hidrocarburs per a síntesi, incloent-hi: etilè, propilè, butadiè, isoprè i ciclopentadiè.
El procés de cracking catalític va dirigit a la producció de combustible i no a la producció de matèries primeres. Involucra la presència d'un catalitzador àcid, generalment àcids sòlids com el silice-alúmina finament dividit a 450-550 °C i sota una lleugera pressió, que promouen l'heteròlisis (ruptura asimètrica) dels enllaços de les molècules que integren fraccions pesades de petroli, produint parells d'ions de càrregues oposades, generalment un carbo-catió i un anió hidrur, que és molt inestable. Els radicals lliures d'alquils i els carbocations són altament inestables i sofreixen processos de reordenament de la cadena i l'excisió de l'enllaç C-C en la posició beta, a més de transferències d'hidrògens o hidrur intramolecular i extramolecular. Aquest procés no solament augmenta la producció de metzina, rompent molècules grans en altres de més petites, sinó que també millora la seva qualitat, ja que es generen alcans i alquens altament ramificats.
En ambdós tipus de processos, els reactius intermediaris (radicals, ions) es regeneren de manera permanent per la qual cosa es tracta d'un mecanisme d'autopropagació en cadena. Eventualment, la cadena de reaccions acaba en una recombinació d'ions o radicals.
Isomerització i reformat d'alcans
La isomerització i reformat són processos en els quals els alcans de cadena lineal són escalfats en presència d'un catalitzador de platí. En la isomerització, els alcans es converteixen en els seus isòmers de cadena ramificada. En el reformat, els alcans es converteixen en les seves formes cícliques o en hidrocarburs aromàtics, alliberant hidrogen com a subproducte. Ambdós processos eleven l'índex d'octà de la substància.
Altres reaccions
En presència d'un catalitzador de níquel els alcans reaccionen amb vapor per a produir hidrogen. Els alcans poden ser clorsulfanats i nitrats, tot i que ambdues reaccions requereixen condicions especials. La fermentació dels alcans en àcids carboxílics és d'importància tècnica. En la Reacció de Reed, el diòxid de sofre i clor converteixen els hidrocarburs en clorurs de sulfinil, en un procés induït per la llum.
Anàlisi dels alcans
Un compost desconegut es caracteritza com un alcà mitjançant proves negatives.
L'anàlisi elemental qualitativa d'un alcà dóna resultats negatius per a tots els elements excepte per al carboni i l'hidrogen. Si s'efectua una combustió quantitativa, es demostra l'absència d'oxigen. Juntament amb una determinació del pes molecular del compost, la combustió dóna la fórmula molecular CnH2n+2 corresponent a l'alcà. Un alcà no és únicament insoluble en aigua, sinó també en àcids i bases dissoltes i àcid sulfúric concentrat; contràriament, la majoria de la resta de composts orgànics es dissolen en un o més d'aquests dissolvents. L'espectre d'aquests en ser irradiats amb radiació infrarroja presenta també bandes d'absorció característiques dels grups atòmics com ara OH, C=O, C=C...; els alcans, en canvi, manquen d'aquesta anàlisi espectral a causa de l'absència de grups funcionals.
Després d'haver determinat que es tracta d'un alcà s'ha de descobrir de quin alcà es tracta. Partint de les seves propietats físiques: punts d'ebullició i fusió, densitat, índex de refracció, espectres infrarrojos i espectrometria de masses, identificarem com un alcà prèviament descrit i d'estructura coneguda. Contràriament, si es tracta d'un alcà nou, la comprovació estructural d'aquest és una tasca bastant complicada.
Aplicacions dels alcans
Les aplicacions d'un cert alcà poden ésser determinades bastant bé d'acord amb el nombre d'àtoms de carboni.
Alcans en estat gasós o líquid molt volàtil
Els quatre primers alcans són usats principalment per a propòsits de calefacció i per a la cuina, en alguns països també s'usen per a generar electricitat. El metà i l'età són els principals components del gas natural; poden esser emmagatzemats en forma gasosa a baixes pressions, tot i que és més fàcil transportar-los en forma líquida, cosa que requereix tant la compressió com el refredament del gas.
El propà i el butà poden ésser líquids a pressions moderadament baixes i són coneguts com a gasos liquats per petroli (GLP). Per exemple el propà s'utilitza en el cremador de gas propà, el butà en els encenedors descartables dels cigarrets. Aquests dos alcans són utilitzats també com propelents en polveritzadors.
Alcans en estat líquid volàtil
En certes condicions l'explosió suau de la mescla combustible-aire és reemplaçada en el cilindre d'un motor de benzina per un colpeig que redueix considerablement la potència del motor, cosa que pot resoldre's amb la utilització d'hidrocarburs amb una tendència anticolpeig (índex d'octà) elevada, en relació a un valor màxim de 100 assignat al 2,2,4-trimetilpentà (iso-octà).
Com a hidrocarburs amb estructures diferents, difereixen àmpliament de la seva tendència al colpeig. Per norma general els alcans ramificats, els alquens i els hidrocarburs aromàtics tenen excel·lents qualitats anticolpeix i s'obtenen a partir dels hidrocarburs del petroli per mitjà del cracking catalític i la reformació catalítica. Els alcans molt ramificats se sintetitzen a partir d'alquens i alcans per alquilació.
Aquesta explicació argumenta la utilització de líquids raonablement volàtils (des del pentà fins a l'octà) com a combustibles en motors de combustió interna, ja que poden vaporitzar ràpidament a l'entrar en la cambra de combustió, sense formar gotes, que romprien la uniformitat de la combustió. Es prefereixen els alcans de cadena ramificada i sobretot el 2,2,4-trimetilpentà (iso-octà), ja que són menys susceptibles a la ignició prematura, causant del cascabelleig en els motors provocats pels seus anàlegs lineals.
A més del seu ús com a combustibles, els alcans mitjans són bons solvents per a substàncies no polars.
Alcans en estat líquid
Els alcans des del nonà fins, podria dir-se, l'hexadecà (un alcà que posseeix 16 àtoms de carboni) són líquids d'alta viscositat, cada vegada menys aptes per al seu ús en benzines. En canvi, formen la major part del gasoli i combustibles per als avions. Els combustibles dièsel estan caracteritzats pel seu índex de cetà (hexadecà). Tot i això, el seu alt punt de fusió pot causar problemes a baixes temperatures i en regions polars on el combustible es torna massa espès per a tenir una fluïdesa adequada.
Els alcans a partir de l'hexadecà constitueixen els components més importants de l'oli combustible i lubricant. La funció dels últims és, també, la d'actuar com a agents anticorrosius, ja que la seva naturalesa hidròfoba implica que l'aigua no pugui arribar a la superfície del metall.
Alcans en estat sòlid
Molts alcans sòlids troben el seu ús com a cera de parafina, per exemple en espelmes; aquesta cera, però, no s'ha de confondre amb la vertadera cera constituïda principalment d'ésters.
Els alcans amb una longitud de cadena d'aproximadament 35 o més àtoms de carboni es troben en el betum. S'usen, per exemple, per a asfaltar els camins. Tot i això, els alcans superiors tenen poc valor i solen rompre's en alcans menors per mitjà de cracking.
Alguns polímers sintètics tals com el polietilè i el propilè són alquens amb cadenes que contenen cents de mils d'àtoms de carboni. Aquests materials s'utilitzen en innombrables aplicacions i es fabriquen milions de tones d'aquests materials al llarg de l'any.
Presència d'alcans en l'univers

El metà i l'età constitueixen una part important en la composició de l'atmosfera de Júpiter (0,1% metà, 0,0002% età), Saturn (0,2% metà, 0,0005% età), Urà (1,99% metà, 0,00025% età) i Neptú (1,5% metà, 1,5ppm età).
Tità, un satèl·lit de Saturn, va ser estudiat per la sonda espacial Huygens, cosa que va permetre conèixer que en l'atmosfera de Tità plou metà líquid a la superfície de la lluna. També es va observar a Tità un volcà que extreia metà, i es creu que aquesta activitat volcànica és una font significativa de metà a l'atmosfera. També sembla que hi ha llacs de metà/età prop de les regions polars nòrdiques de Tità, com ho va descobrir el sistema d'imatges per radar de la sonda Cassini. També s'ha detectat metà i età a la cua del cometa Hyakutake. L'anàlisi química mostrà que els gels formats en l'espai interestel·lar, lluny del sol, podrien haver-se evaporat en forma desigual degut a la diferent volatilitat d'aquestes molècules. També s'han detectat alcans en meteorits com les condrites carbonàcies.
Abundància dels alcans a la Terra
El petroli és una mescla d'alcans líquids i altres hidrocarburs, que varen formar-se a partir d'animals marins i plantes (zooplàncton i fitoplàncton) morts i enfonsats en el fons dels mars antics i coberts amb sediments durant milions d'anys a altes temperatures i pressions, fins a la forma actual.
El gas natural, per exemple, es pot obtenir de la reacció:
C6H12O6 → 3CH4 + 3CO2
Aquests hidrocarburs varen ser absorbits en roques poroses i es varen localitzar en una càpsula impermeable de roca quedant-se atrapats. A diferència del metà, que es forma en grans quantitats, fins i tot de manera excessiva, els alcans superiors (alcans amb 9 àtoms de carboni o més) rares vegades es produeixen en grans quantitats en la naturalesa. Així doncs, aquests dipòsits, camps de petroli, s'han format durant milions d'anys i una vegada exhaurits no poden ser reemplaçats ràpidament. L'esgotament d'aquests hidrocarburs és la base del que es coneix com crisi energètica.
Els alcans sòlids com el quitrà es formen quan els alcans més volàtils, com ara gasos i olis s'alliberen dels dipòsits d'hidrocarburs. Un dels dipòsits més gran d'alcans sòlids és el llac d'asfalt conegut com el llac Pitch situat a Trinitat i Tobago.
El metà també es troba present en l'anomenat biogàs, produït per animals i matèria en descomposició, que és una possible font renovable d'energia.
Tot i que el metà, com la resta d'alcans, presenta una baixa solubilitat en aigua, a altes pressions i temperatures molt baixes, com són les dels fons dels oceans pot co-cristal·litzar amb aquesta per formar hidrat de metà de naturalesa sòlida. La quantitat d'energia combustible d'aquests camps d'hidrat de metà sobrepassa el contingut energètic de tots els dipòsits de gas natural i petroli junts; així el metà extret del clatrat de metà es considera un candidat per a combustibles futurs. Però els científics tenen la tasca d'idear la manera d'extreure aquests grans blocs sense causar un desastre ambiental, ja que es troba sota el permafrost i la plataforma continental.
El biogàs és l'alternativa al gas natural, està constituït per: Metà (CH4):55,68%. Dióxid de carboni (CO2): 34,85%. Nitrogen (N2): 9,61%. Oxigen (O2): 0,63%. Àcid sulfhídric (SH2), amoníac (NH3) i compostos orgànics volàtils (VOC's) en quantitats poc significatives

En aquesta il·lustració es mostra un tanc de biogàs.

Refineria de petroli.
Importància dels alcans en fongs i plantes
Els alcans també juguen un rol, si bé menor, en la biologia dels tres grups d'organismes eucariotes: fongs, plantes i animals. Alguns llevats especialitzats, com Candida tropicale, Pichia sp. o Rhodotorula sp., poden utilitzar alcans com una font de carboni i/o energia. El fong Amorphotheca resinae prefereix els alcans de cadena llarga dels combustibles d'aviació, i poden causar seriosos problemes als avions en les regions tropicals. En les plantes, hi podem trobar alcans sòlids de cadena llarga formant una ferma capa de cera, la cutícula, sobre l'àrea de les plantes exposades a l'aire. Aquesta protegeix la planta de la pèrdua d'aigua, així com evita el leaching de minerals importants per la pluja. També és una protecció contra els bacteris, fongs, i insectes perjudicials. Aquests últims s'enfonsen amb les seves potes en la substància cerosa suau i tenen més dificultat per a moure's. La capa brillant sobre les fruites, com ara les pomes, està constituïda per alcans de cadena llarga. Les cadenes de carboni tenen generalment entre vint i trenta àtoms de carboni de longitud, i les plantes les preparen a partir dels àcids grassos. La composició exacta de la pel·lícula de cera no depèn únicament de l'espècie, sinó també de l'estació de l'any; els factors ambientals, com ara les condicions d'il·luminació, temperatures o la humitat.

Aquesta capa brillant està constituïda per alcans de cadena llarga i ofereix protecció a la fruita front la reactivitat de l'aigua, degut a la hidrofobicitat d'aquesta fruita
Importància dels alcans en animals
Els alcans es troben en productes animals, tot i que són menys importants que els hidrocarburs insaturats. Un exemple és l'oli de fetge de tauró, format en un 14% per pristà (2,6,10,14-tetrametilnonadecà, C19H40). La seva abundància és més significativa en les feromones, missatgers químics, que representen la base de quasi tota la comunicació entre insectes. En alguns tipus com l'escarabat Xylotrechus colonus, principalment el petacosà (C25H52), 3-metilhexacosà (C26H54) i 9-metilhexacosà (C26H54), es transfereixen per contacte corporal. En altres com ara la mosca tsé-tsé Glossina morsitans morsitans, la feromona conté els quatre alcans 2-metiloctodecà (C18H38), 17,21-dimetilnonatriacontà (C39H80), 15,19-dimetilnonatriacontà (C39H80) i 15,19,23-trimetiltetracontà (C40H82), que actua mitjançant l'olfacte en distàncies llargues, una característica molt útil pel que fa al control de plagues.
Relacions ecològiques, en les quals els alcans juguen una importància clau
Un exemple en què tant els alcans de les plantes com els dels animals juguen un rol important és la relació entre l'abella Andrena nigroaenea i l'orquídia Ophrys sphegodes; aquesta última depèn, per a poder pol·linitzar-se, de la primera. Les abelles Andrena nigroaenea usen feromones per a identificar un company; en el cas d'A. nigroaenea, les femelles emeten una mescla de tricosà (C23H48), petacosà (C25H52) i heptacosà (C27H56) en la proporció 3:3:1, i els mascles són atrets específicament per aquesta olor. L'orquídia pren avantatge d'aquest aparellament per fer que les abelles mascle recol·lectin i disseminin el seu pol·len; no només les seves flors s'assemblen a aquest tipus d'abella, sinó que també produeixen grans quantitats dels tres alcans en la mateixa proporció que les abelles A. nigroaenea femella. Com a resultat, nombrosos mascles són atrets a les flors i intenten copular amb la seva companya imaginària; tot i que aquest comportament no es corona amb l'èxit per a l'abella, permet a l'orquídia la transferència del seu pol·len, que es dispersarà quan l'abella abandoni la planta.
Riscos i perills dels alcans
El metà és explosiu quan es troba mesclat amb l'aire (1 – 8% CH4) i és un agent molt fort en l'efecte hivernacle. Altres alcans menors també formen mescles explosives amb l'aire. Els alcans líquids lleugers són altament inflamables, tot i que aquest risc decreix amb l'augment de la longitud de la cadena de carboni, ja que cada vegada es necessiten temperatures més altes. El pentà, l'hexà, l'heptà i l'octà estan classificats com a perillosos per al medi ambient i nocius. L'isòmer de cadena lineal de l'hexà és una neurotoxina.
Perills del metà
El metà té un sol carboni i quatre hidrògens. La forma general de la molècula és un tetraedre, una figura amb quatre cares triangulars idèntiques, amb un àtom d'hidrogen en cada vèrtex i l'àtom de carboni en el centre. És més lleuger que l'aire, incolor, inodor i inflamable, forma part del gas natural (entre un 75% i un 90%) juntament amb l'età i una petita proporció de propà. També es troba en el gas que s'acumula en les mines de carbó, on pren el nom de grisú i és molt perillós a causa de la seva facilitat per a inflamar-se i provocar explosions. D'aquesta manera, al llarg de la història, han perdut la vida molts miners. Actualment s'utilitza una làmpada de seguretat inventada per Humphrey Davy en la qual una tela metàl·lica envolta la flama, refreda la mescla gasosa interna i impedeix així una inflamació del grisú.
Certs tipus de bacteris poden metabolitzar els alcans. Són més fàcils de degradar aquells que tenen un nombre parell de carbonis respecte a les cadenes de longitud imparell.
Descomposició d'alcans, metanògens
El terme descomposició pot aplicar-se per referir-nos al fenomen de desintegració biològica o putrefacció causat pels microorganismes. Mitjançant descomposició obtenim també productes útils com el petroli.
El 60% de les emissions de metà en tot el món és d'origen antropogènic, és a dir són produïdes en funció de l'activitat humana o són producte d'accions orientades al nostre benefici, principalment d'activitats agrícoles. La concentració d'aquest gas s'ha incrementat de 0.8 a 1.7 ppm en els últims 200 anys.
Pràcticament la totalitat del metà de la terra és produït directament o indirectament per organismes. Una petita proporció prové de les plantes en descomposició, enterrades, les parts dissoltes de les quals, es converteixen en querossè, que pot patir una ruptura tèrmica i produir metà i altres hidrocarburs saturats de cadena més llarga.
Una gran quantitat de metà, però, prové de microbis anaerobis anomenats metanògens. Alguns d'ells poden suportar situacions adverses i extremes pel que fa al pH del medi, la temperatura (alguns habiten en medis que es troben entre els 80 i 100 graus °C, altres a l'Antàrtida) o la salinitat. A causa d'aquesta resistència, es troben extremadament estesos per tot el planeta i la seva existència apareix en qualsevol medi físic en absència d'oxigen (tracte intestinal de rumiants, sòl, subsòl...).
Així, els bacteris metanògens obtenen la seva energia a través de la producció metabòlica del gas metà a partir de diòxid de carboni o altres compostos orgànics i d'hidrogen, que sofreix una oxidació i es converteix en aigua. La majoria són anaerobis, tot i que algun pot sobreviure en presència d'una mínima quantitat d'oxigen. Els bacteris d'aquest gènere provoquen la descomposició anaeròbia de la matèria d'origen vegetal; per aquest motiu es troben a les basses, en el sòl i en el tracte digestiu de les vaques i altres rumiants. S'utilitzen en les plantes depuradores d'aigües.
Aquest procés respon a la fórmula:
CO2 + 4H2 → CH4 + 2H2O

Els bacteris de la família archea que habiten en simbiosi en el tracte intestinal del rumiant, descomponen, anaeròbicament, la matèria d'origen vegetal i alliberen a l'atmosfera, com a subproducte d'aquesta digestió, una quantitat important i molt contaminant de metà. La producció de metà d'alguns herbívors pot superar fins i tot els 150 litres per dia.
Curiosament, també produeixen metà els metanògens que es troben en sistemes digestius dels tèrmits.
Antigament s'anomenava al metà el gas dels pantans, a causa de la seva acumulació en medis anaerobis com eren els fons de les aigües en descomposició dels pantans, en les quals hi trobem també metanògens, que alliberen al voltant de dos milions de tones de metà per any.
Acció del metà sobre el canvi climàtic
El metà és un gas que intensifica molt l'efecte hivernacle que pateix el planeta a causa de l'elevada concentració amb què el trobem en l'atmosfera, actualment 1,7 ppm. La concentració de metà sembla haver-se estabilitzat en els últims anys, ja sigui per l'augment de l'ozó que el descompon o per un major control de les emissions després d'haver sofert un increment bestial des dels anys 80 per la industrialització.
L'agricultura i la ramaderia són les principals activitats humanes productores de metà. 400 milions de tones de metà són produïdes anualment per microbis que viuen en condiciones anaeròbies (l'estómac d'un rumiant, l'interior d'un femer, un camp inundat pel cultiu d'arròs o el fons d'uns aiguamoll), degradant la matèria orgànica.
Així doncs, la figura de l'home ha intensificat el problema mitjançant la superproducció de carn vermella com ara la de vedella, cosa que requereix el criança de milions de vaques més que en anys enrere i per tant l'alliberament dels subproductes de la seva digestió, com ara el metà, per part de les bacteris que habiten el seu tracte intestinal.
Els escapaments dels gasoductes que transporten el gas natural ha provocat, també, la fuga a l'atmosfera de tones de metà.
Estudis efectuats sobre l'acció dels gasos hivernacle de manera aïllada per tal d'evitar que la presència d'un alteri la composició d'un altre per així estimar l'efecte que exerceix cadascun d'ells en l'escalfament del planeta demostren que el metà contribueix al canvi climàtic d'una manera alarmant: el seu impacte en l'efecte hivernacle sembla haver-se duplicat respecte al que era d'esperar.
Butà, risc per combustió incompleta
El butà és un hidrocarbur molt important pel que fa al consum domèstic. Té una gran densitat respecte a l'aire i s'utilitza a bastament com a combustible. El risc major de la seva utilització recau en les combustions incompletes, que es produeixen per acumulacions de butà sense prou presència d'oxigen per a oxidar-lo completament, cosa que dóna lloc a intoxicacions mortals de monòxid de carboni.
Hexà, heptà, nonà i dodecà.
L'hexà té sis carbonis saturats totalment amb l'hidrogen. Es tracta d'un líquid que s'emprava com a dissolvent de pintures, de coles o en la indústria del calçat. L'hexà va ser molt usat, però es va intentar substituir per dissolvents menys tòxics com ara l'heptà.
- L'hexà: afecta les funcions portades a terme pel SNC provocant cefalees, vertígens o marejos... també és responsable de la irritació de mucoses respiratòries. De fet, l'isòmer de cadena lineal de l'hexà és molt perillós, ja que és una neurotoxina, de manera que pot ser el causant de polineuritis, tant sensitiva com motora, podent afectar les quatre extremitats, sobretot les cames. També existeix un risc d'afectació del nervi òptic, havent-hi canvis de sensibilitat en la visió dels colors. Pot afectar, també, la musculatura respiratòria.
- L'heptà segueix el mateix esquema que l'hexà però en menor intensitat.
- El nonà és un component important de la gasolina, trobant-se a l'atmosfera de grans ciutats juntament amb molts altres productes. El dodecà es troba també a la gasolina i és un potenciador d'alguns cancerígens.
Hidrocarburs no cremats
A més de diòxid de carboni i aigua, els motors de gasolina descarreguen a l'atmosfera altres substàncies que són contaminants o clarament verinoses: hidrocarburs no cremats, monòxid de carboni, òxids de nitrogen... De la benzina emplomada també es desprenen diversos compostos de plom. La inquietud pública creixent entorn d'aquests contaminants ha causat una petita revolució en les indústries del petroli i l'automòbil. S'estan desenvolupant convertidors per a netejar les emissions del tub d'escapament, ja sigui per oxidació catalítica d'hidrocarburs i monòxid de carboni o per degradació d'òxids de nitrogen en nitrogen i oxigen. Tot i això la majoria d'aquests catalitzadors contenen platí, que és enverinat pel plom.
Fonts industrials d'alcans
- La font principal d'alcans és el petroli, juntament amb el gas natural que l'acompanya. La putrefacció i les tensions geològiques han transformat, en el transcurs de milions d'anys, compostos orgànics complexos que una vegada varen constituir plantes o animals vius, en una mescla d'alcans d'1 fins a 30 o 40 carbonis. Junt a aquests, i especialment abundants en el petroli de Califòrnia, s'hi troben els cicloalcans, que en la indústria petrolera s'anomenen naftens
El petroli se separa per destil·lació en diverses fraccions a causa de la relació entre punt d'ebullició i pes molecular, això suposa una separació preliminar d'acord amb el nombre de carbonis. Cada fracció és encara una mescla complexa, ja que conté alcans amb un interval d'àtoms de carboni i per a cada nombre determinat de carbonis existeixen diversos isòmers. L'ús de cada fracció depèn principalment de la seva volatilitat o viscositat i no té pràcticament importància que es tracti d'un compost pur o una mescla complexa.
- Una segona font potencial d'alcans es troba constituïda per l'altre combustible fòssil, el carbó; s'estan desenvolupant processos que el converteixen per mitjà de la hidrogenació, en benzina i petroli combustible, així com gas sintètic per a compensar la previsible mancança de gas natural.
- Evidentment, el gas natural únicament conté els alcans més volàtils, és a dir, els de menor pes molecular; està constituït en essència per metà i quantitats progressivament menors d'età, propà, i alcans superiors. Una mostra obtinguda d'un oleoducte alimentat per un gran nombre de pous de Pennsilvània contenia metà, età i propà en una proporció de: 12:2:1; els alcans superiors representaven només el 3% del total. La fracció propà-butà se separa dels components més volàtils per liquació, es comprimeix en cilindres i es ven com a gas liquat en àrees que no en tenen.
Utilitats del petroli
El principal ús de totes les seves fraccions volàtils és com a combustible: La fracció gasosa, com passa amb el gas natural, s'utilitza sobretot en calefacció. La benzina s'utilitza en maquinària de combustió interna que requereix combustibles bastant volàtils; el querossè s'utilitza en motors de tractor i reactors, i el gasoli en motors dièsel. Aquests dos últims s'utilitzen també per a calefacció.
La fracció d'oli lubrificant, especialment la procedent de crus de Pennsilvània (petroli de base parafínica), sovint conté grans quantitats d'alcans de cadena llarga (C20-C34), amb punts de fusió molt elevats. Si aquests romanessin en l'oli, en dies freds podrien cristal·litzar en forma de sòlids cerosos en els oleoductes; per a prevenir-ho es refreda l'oli i se'n separa la cera per filtració, que es ven com a cera parafínica (p.f. 50-55 °C), que una vegada purificada, pot utilitzar-se com a gelatina de petrolat (vaselina). L'asfalt s'utilitza per a impermeabilitzar terrats i per a la pavimentació de carreteres.
L'éter del petroli i la betzinaligroïna són disolvents útils per a molts materials orgànics de baixa polaritat.
A més d'utilitzar-se directament, com s'acaba de descriure, certes fraccions del petroli es converteixen en altres classes de composts químics. La isomerització catalítica transforma alcans de cadena recta en ramificats; el procés de cracking converteix alcans superiors en inferiors i en alquens, amb la qual cosa s'augmenta el rendiment de la benzina, fins i tot pot usar-se per a la producció de gas natural. Els alquens així formats constitueixen potser les matèries primeres més importants per a la síntesi de substàncies alifàtiques a gran escala. El procés de reforma catalítica converteix els alcans i els cicloalcans en hidrocarburs aromàtics, amb la qual cosa es contribueix a proporcionar matèries primeres per a la síntesi a gran escala d'una altra àmplia gamma de compostos.
Producció d'alcans
Refinat de petroli
La font natural més important d'alcans és el gas natural i el petroli cru. Els alcans són separats en una refineria de petroli per destil·lació fraccionada i processats en molts productes diferents.
Una refineria de petroli situada a Martínez, a l'estat de Califòrnia.
- Fischer-Tropsch
El procés Fischer-Tropsch és un mètode per a sintetitzar hidrocarburs líquids, incloent alcans, a partir de monòxid de carboni i hidrogen. Aquest mètode s'utilitza per a produir substituts pels destil·lats de petroli.
Preparació d'alcans en el laboratori
Generalment hi ha poca necessitat de sintetitzar alcans en el laboratori, ja que solen estar disponibles comercialment. També es deu al fet que els alcans són, en general, poc reactius, químicament i biològicament, i no sofreixen interconversions netes de grups funcionals. Quan es produeix un alcà en el laboratori sol ser el subproducte d'una reacció. Per exemple, l'ús de n-butil-liti, com una base, produeix l'àcid conjugat, n-butà com a subproducte, obeint a la següent reacció:
C4H9Li + H2O → C4H10 + LiOH
- Tot i això, a vegades pot ser desitjable convertir una porció d'una molècula en una estructura funcionalment alcànica (grup alquil) usant un mètode com el de dalt, o mètodes similars. Per exemple, un grup etilè és un grup alquil que quan es troba unit a un grup hidroxi constitueix l'etanol, que no és un alcà. Per a convertir-lo en un alcà, un dels mètodes més coneguts és la hidrogenació d'alquens.
- RCH=CH2 + H2 → RCH2CH3 (R = grup alquil)
- Els alcans o grups alquil poden ser preparats directament a partir d' haloalcans en la reacció de Corey-House-Posner-Whitesides. La desoxigenació de Barton-McCombie elimina el grup hidroxil dels alcohols.
- La reducció de Clemmensen elimina els grups carbonil dels aldehids i cetones per a formar alcans o compostos de substituïts d'alquil.
Bibliografia
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Alcà |
- Webgrafia
Propiedades físicas de los alcanos (castellà)
- «Cicloalcanos». [Consulta: 20 juliol 2012].
- «Quiored - Formulación - Introducción». [Consulta: 20 juliol 2012].
- «Alcanos y Cicloalcanos». [Consulta: 20 juliol 2012].
- [Titan: Arizona in an Icebox?, Emily Lakdawalla, 2004-01-21, verified 2005-03-28]
- Bibliografia
- Jacint Corbella.Risc i patologies per hidrocarburs, 1993.
- Lehninger. Editorial Omega: Principios de bioquimica, 2006.